最新!百济神州2款新药拟纳入优先审评
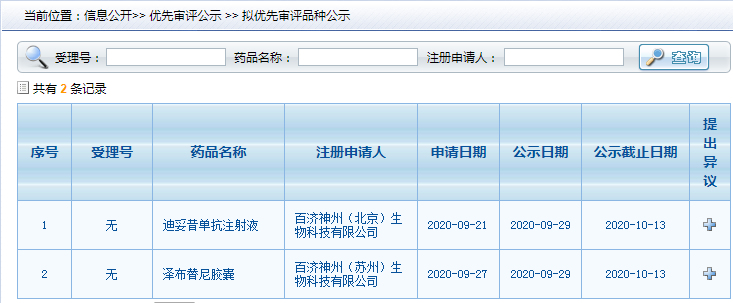
9月29日,根据中国国家药监局药品审评中心(CDE)公示信息,百济神州2款新药拟纳入优先审评:迪妥昔单抗注射液和BTK抑制剂泽布替尼胶囊。
此次迪妥昔单抗拟纳入优先审评的适应症为:适用于治疗≥12月龄的高危神经母细胞瘤患者,这些患者既往接受过诱导化疗且至少获得部分缓解,并且随后进行过清髓性治疗和干细胞移植治疗;也适用于治疗伴或不伴有残留病灶的复发性或难治性神经母细胞瘤。在治疗复发性神经母细胞瘤之前,应采取适当措施使活动性进展性疾病保持稳定。针对具有复发/难治性疾病病史和一线治疗后尚未达到完全缓解的患者,应使用迪妥昔单抗联合白介素2(IL-2)治疗。
神经母细胞瘤是婴幼儿中最常见的癌症之一。它是一种极具侵袭性的肿瘤,即使采用高度强效的治疗,患者的生存率仍低于50%。因为恶性程度高,治疗难度大,它被称为“儿童肿瘤之王”。
据公开信息显示,迪妥昔单抗是一款单克隆抗体QARZIBA(dinutuximab beta),它可以与神经母细胞瘤细胞过度表达的特定靶标GD2结合,这可以诱导双重免疫机制,使免疫系统破坏神经母细胞瘤的癌细胞。今年1月,EUSA Pharma与百济神州签署协议,EUSA Pharma授权百济神州在中国大陆独家开发和商业化dinutuximab beta的权利。
2017年,Dinutuximab beta获得欧盟委员会批准用于治疗一岁以上的先前接受过诱导化疗并达到部分缓解的高危神经母细胞瘤患者,随后进行清髓性治疗和干细胞移植,或者复发或难治性神经母细胞瘤的患者,无论是否有残留病灶。这也是欧洲药品管理局(EMA)唯一批准的用于治疗高危神经母细胞瘤的靶向肿瘤免疫疗法。
BTK抑制剂泽布替尼胶囊此次纳入优先审评的适应症为:适用于治疗成人华氏巨球蛋白血症(WM)患者。
这是一款设计旨在最大化靶点占有率、最小化脱靶效应的小分子布鲁顿酪氨酸激酶(BTK)抑制剂。2019年1月,泽布替尼基于一项中国的临床研究成为FDA历史上第一次被授予“突破性疗法认定”抗癌创新药。2019年8月,FDA第一次基于一项中国的临床研究受理新药上市的申请,到2019年11月15日,泽布替尼为唯一获得FDA批准上市的我国完全自主研发的创新药。
从获批适应症来看,泽布替尼此前在美国已获批用于治疗既往接受过至少一项疗法的成人套细胞淋巴瘤(MCL)患者,在中国获批用于治疗以下两项适应症:既往接受过至少一项疗法的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者,以及既往接受过至少一项疗法的成年MCL患者。
而此次纳入优先审评的华氏巨球蛋白血症是一种罕见的以血液中呈现大量单克隆巨球蛋白(IgM)为特征的B淋巴细胞恶性病变,约占所有非霍奇淋巴瘤的1%,通常在确诊后进展缓慢。患者会出现如贫血、疲劳和盗汗等相关症状。
根据百济神州在2020ASCO年会上公布有关于泽布替尼作为单药用于治疗初治或复发/难治华氏巨球蛋白血症患者的1/2期临床试验的数据显示,在中位随访为35.3个月的情况下,73%的患者仍在接受治疗,ORR达到96%,VGPR/CR率为46%。随着治疗时间增加,达到最佳缓解(VGPR或CR)的患者也有增加,3年PFS无病率为80%,总生存期为83%。
试验结果有力地证明了泽布替尼是一款强效BTK抑制剂,在安全性和耐受性上有显著提升。值得一提的是,在此前9月份,泽布替尼针对该适应症的新药上市申请已获得加拿大药监部门受理,并被纳入优先审评。


文章评论(0)