重磅!澳大利亚生物医药产业2019白皮书(附获取方式)!
在此,小编选取了部分内容,如果您需要《白皮书》全文,可在文末获取。

图片来源:《Why Australia for Clinical Trials Presentation》(Austrade)
在2014年,为进一步提升在临床试验领域的全球竞争地位,澳大利亚成立一个临床试验项目参考小组(CTPRG),CTPRG力求确定并实施行动和重新设计系统,实现国内流程简化:组织各方展开多个论坛,分成各个小组,最终形成多个议题报告,提交TGA(Therapeutic Goods Administration)并获得认可。
早在2011年,TGA重新对澳大利亚临床试验行业竞争力做出定位:技术数量的方式,高性价比,及时交付高价值活动,不与低成本临床试验国家做竞争。就是让先进药物能在获批前数年就能让有需求的病人接触,尤其是那些严重威胁人类健康的疾病潜在有效的药物,这些治疗手段必须是富有临床实践价值,而且通过标准化操作能提高澳大利亚医疗服务圈的治疗理念与操作水平的。
澳大利亚还推出了全国相互认可计划(NMA),旨在实现多中心临床试验科学与伦理审查的相互认可;制定了临床试验成本的标准化,帮助赞助商可靠地预测在澳进行临床试验的成本,显著减少他们与各个试验单位洽谈合同的时间。
另外,作为三大政府补贴机制主体之一的澳大利亚国家健康与医学研究理事会(NHMRC,Australian Government National Health and Medical Research Council),起着最重要的作用,通过以下:
• 确保临床研究中心表现卓越;
• 临床执业医师奖金补偿;
• 临床执业发展奖;
• 启用拨款,计划拨款,项目拨款(包括大规模临床试验)和临床领域的合作项目。
而在我国,从国家层面的投资支持力度是比较缺乏的。中国机构对这些的奖励,主要是通过减免机构管理费、检查费用、服务费等,力度有限。
图片来源:《Why Australia for Clinical Trials Presentation》(Austrade)
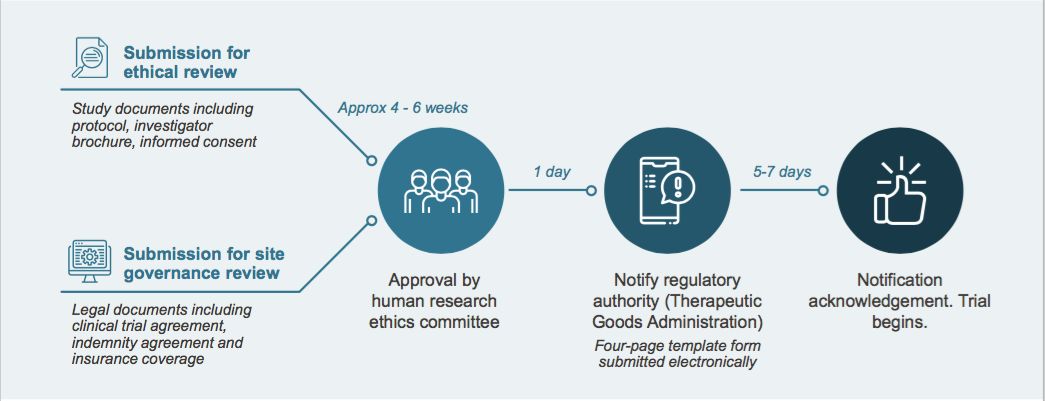
澳大利亚有三分之一的临床试验都在维多利亚州进行,且所得的临床研究数据一般能够获得美国和欧盟的认可。在中国,做一期临床实验一般需要12~18个月,而如上图所示,在澳大利亚仅需6周即可完成,99%的一期临床试验在完成注册后一周内即可启动。即使回到中国重做一期临床,时间进度也会大大缩短,这也为海外药企创造了机会。
1. 澳大利亚灵活可靠的监管制度
2. 知识产权保护
3. 研发税收激励措施
4. 对生物医药领域的支持性商业文化(研究基金、生物医学转化基金等)
由于篇幅原因,小编着重引用些普遍受关注的知识产品保护方面内容。
澳大利亚拥有世界上最健全、最稳定的知识产权体系之一。根据“国际产权索引”,其知识产权体系在安全性方面位居全世界第11位,可与德国、日本和英国的相媲美。澳大利亚知识产权体系的部分主要优势包括:
· 数据专属权
澳大利亚的数据专属权法律禁止竞争对手在五年之内利用专有的安全性与功效数据,起始时间即新型药物或疫苗初次列入“澳大利亚治疗用品登记册”之日。
· 创新专利
在澳大利亚,创新专利最多可持续八年时间,与标准专利的20年期限相比,其设计旨在保护尚未达到标准专利所要求的发明门槛的发明。
· 专利期限延长
根据“世贸组织与贸易相关的知识产权协议”,澳大利亚授予(标准)专利所有人20年的保护期限。发明新药和进入市场通常花费昂贵,这些发明很容易通过所谓的“逆向工程”被仿制,所以对新药产品的专利保护尤显重要。
另外,《白皮书》还提到了在新药销售时可能已超过专利保护期限情况下的做法,了解更多,请翻到文末查阅《白皮书》原文,以下为目录:
目录

由于篇幅所限,
欢迎大家通过以下方式获取《白皮书》全文:
1. 添加官方微信号BioclubCAMIP
2. 扫描下方二维码添加好友,备注“白皮书”

关于中澳生物医药产业科技园
中澳生物医药产业科技园(CAMIP)是由杭州高新区(滨江)积极响应科技部火炬中心“一带一路”创新中心建设和国际科技合作号召,与科技部火炬中心联合共建,委托贝壳社为独家运营方,协同海内外产业链上下游生物医药核心关键技术公司网络,引进全球领先的拥有自主知识产权和经过临床验证的创新药、高端医疗器械和精准诊断的产品和技术落地中国,打造国内国际级生物医药产业高能级创新平台的标杆。


文章评论(0)