国内首个PD-L1要来了!免疫治疗的另一半江湖或将掀起 | 医线追踪
PD-1热度未消,PD-L1也要来了。
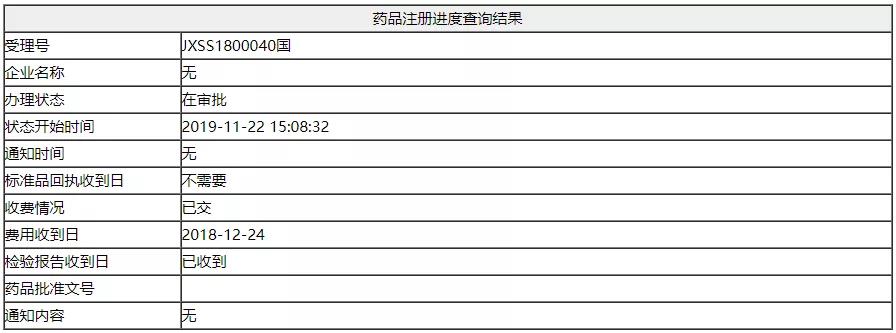
日前,阿斯利康旗下PD-L1免疫检查点抑制剂Durvalumab注射液(Imfinzi,简称“I药”)在中国国家药监局药品审评中心(CDE)的审评状态更新为在审批,这距离CDE正式承办其上市申请(2018年12月26日)不到一年时间。
图片来源:
国家药监局药品审评中心
这是首个在中国申请上市的PD-L1单抗。据悉,“I药”预计将于2019年Q4获批,并成为国内首个上市的PD-L1 单抗药物,用于治疗不可手术的 Ⅲ 期非小细胞肺癌(NSCLC)。
从全球来看,目前已上市的PD-L1单抗药物共3款:阿斯利康Imfinzi(durvalumab)、罗氏Tecentriq(atezolizumab),默克&辉瑞Bavencio(avelumab),其中阿斯利康和罗氏已先后在中国提交上市申报。
就本土药企来说,根据Insight 数据库最新数据,目前国内临床在研 PD-L1 抗体已有 15 个品种(涉及 54 个临床登记号),其中4家企业已处于临床Ⅲ 期,赛道的拥挤程度和竞争的残酷性完全不输PD-1。
如果说PD-1已进入群雄逐鹿的“战国时代”,那么等待PD-L1的又是一个怎样的江湖?
这一定位也被认为是另辟蹊径,开创了免疫治疗在肺癌领域的新用法,瞄准局部晚期NSCLC的巩固治疗,巧妙避开了与“K药”和“O药”在适应症上的竞争。
而“I药”一战成名,背后最经典的研究当属PACIFIC,其也被誉为“来自太平洋的风暴”。
在肺癌患者类型中,一般约三分之一在发现时已处于III期阶段,其中一类为不可手术的患者,对于这些患者来说,放疗+化疗的标准方案下的生存预后往往并不理想。
PACIFIC研究正是基于这一痛点应运而生。它被定义为一项随机、双盲、安慰剂对照的国际多中心临床III 研究,不可手术切除的 III 期 NSCLC 同步放化疗后未进展的患者,随机分组采用 Imfinzi 作为序贯疗法。
2017年5月,阿斯利康宣布PACIFIC研究中期分析取得的积极结果,也正是基于这一结果,FDA授予了“I药”突破性药物资格。这一年9月的ESMO大会上,PACIFIC研究结果公布。数据显示,“I药”显著延长无进展生存期(PFS)超过11个月(16.8 个月 vs 5.6 个月;HR=0.52;95%CI:0.42-0.65)。
在2019年ASCO年会上,PACIFIC研究公布的最新成果又显示,第三代“I药”在局部晚期非小细胞肺癌治疗领域的重要地位再次凸显,3年生存率高达57%。安全性方面,经“I药”治疗3年的患者超过1/3(40%左右)III期患者既未死亡,也未发生远端转移,而对照组这一数据仅为1/5。
据悉,“I药”已被49个国家(美国、日本和整个欧盟等)批准作为III期NSCLC放化疗后无法切除的治疗方案。在中国,目前“I药”有针对非小细胞肺癌、局限期小细胞肺癌、尿路上皮癌、肝细胞癌等适应症的多项研究正在进行。
接下来,如果“I药”成功在中国的获批上市,无论对于中国患者、市场还是阿斯利康本身,的确都应该是一件值得期待的事情。
不过,作为PD-1的兄弟药物,PD-L1在中国市场又将有着怎样的命运?
PD-1和PD-L1各有优劣,PD-1抑制剂无法阻断PD-L1与CD80的结合,而PD-L1抑制剂无法阻断PD-1与PD-L2的结合。但由于都是作用于同一条免疫通路,通常情况下两者被认为是大同小异。
不过一些研究结论表明,对比目前已上市的PD-1药物,PD-L1在疗效、安全性等方面存在一定优势,具体如下:
1.疗效:从临床疗效来看,PD-L1单抗虽然起步较晚,但其疗效数据却毫不逊色, PD-L1单抗可同时阻断肿瘤细胞上PD-L1对B7.1和PD-1的共抑制功能,有利于全面激活T细胞,理论上具有更好杀伤肿瘤的优势。
2.安全:PD-1单抗同时阻断肿瘤上的PD-L1和PD-L2双位点与PD-1结合,而PD-L1单抗只单阻断PD-L1与PD-1结合,并不影响PD1-PDL2通路,避免后者受影响引发的ILD等副作用的发生。因此理论上认为,PD-L1单抗比PD-1更加安全、低毒。
3.抗抗体效应:免疫学专家陈列平教授曾经指出,部分PD1单抗耐药的患者使用PDL1单抗药物后依然会有效。机体对PD1单抗耐药的原因并不是真正的肿瘤药物耐药,是基于机体对药物抗体自身的抗原属性产生了抗体,免疫学上称为抗抗体。
不过在市场趋势上,PD-L1单抗似乎却像极了PD-1。
在另外两款海外上市的PD-L1药物中,罗氏Tecentriq是FDA批准的首个PD-L1抑制剂,目前获批适应症包括局部晚期或转移性尿路上皮癌和转移性非小细胞肺癌。值得一提的是,今年3月,FDA批准Tecentriq联合化疗(卡铂和依托泊苷),用于广泛期小细胞肺癌(ES-SCLC)的一线治疗,这是20多年来FDA首次批准的唯一一个SCLC治疗新手段,被认为是SCLC治疗史上的里程碑事件。
商业化层面,有数据预测5年后Tecentriq销售额预计将会突破50亿美元。从此前2018年财务数据来看,Tecentriq也创下了7.89亿美元的销售额,同比增长率高达59.5%
2017年,默克&辉瑞Bavencio成为FDA批准的第二个PD-L1抑制剂,用于治疗罹患转移性默克尔细胞癌(MCC),这也是FDA批准的首个治疗MCC的疗法。随后,Bavencio又被加速批准用于二线治疗局部晚期转移性尿路上皮癌。2018年,Bavencio 全球收入达6900万欧元。
在国内市场,除了已经上市申报的阿斯利康Imfinzi和罗氏Tecentriq,目前PD-L1抗体临床在研企业已多达15家,其中处于临床 3 期的国产第一梯队包括恒瑞 SHR-1316 注射液、中国生物制药 TQB2450 注射液、基石药业的CS1001和康宁杰瑞 KN035。
拿KN035来说,其被认为是康宁杰瑞有望最先商业化的产品,其也是国产PD-L1进度最快的产品之一。与阿斯利康“I药”另辟蹊径的思路一致,KN035在激烈的竞争中主打“单域抗体”和“皮下注射”两大差异化卖点。
如此来看,无论是国内首款还是首款国产PD-L1,似乎都并不遥远。
不过,作为中国免疫治疗的另一半江湖,PD-L1市场又将是一番怎样的格局,谁又将是“下一个K药”,我们拭目以待。


文章评论(0)