诺华持股15%,这家公司刚融了1.1亿美金,现又重启IPO
7月6日,细胞和基因疗法初创公司Poseida Therapeutics宣布将以14-16美元的价位区间发行1000万股,拟IPO募资1.5亿美元。据外媒报道,如果最终的发行价在区间中点价位以上,那么Poseida Therapeutics最终市值将达到8.9亿美元。
实际上这并不是Poseida Therapeutics首次谋求上市。2019年年初,该公司便开始了在纳斯达克的上市计划,不过由于当时“令人不安的市场情绪”,该公司随后撤回了IPO申请,转而启动了C轮大型融资。
直到今年6月份,Poseida Therapeutics再度提交上市申请文件。而有趣的是,就在重启IPO的一周后,该公司又再一次宣布已完成D轮融资,募得资金1.1亿美元。
一前一后,剧情似乎有些类似。在这一年左右时间里,Poseida Therapeutics算是“漂亮”地完成了两轮融资,不过其IPO之路这一次又是否能够成功?
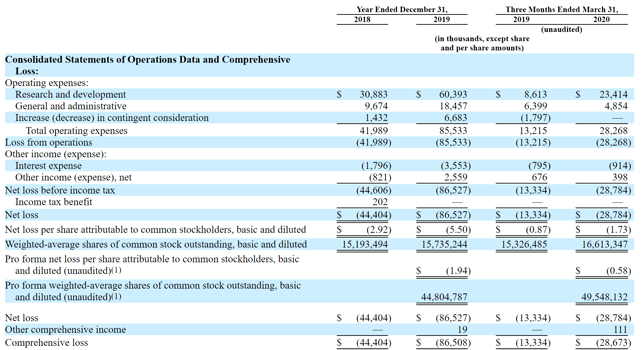
从招股书数据来看,这是一家处于临床阶段的生物技术公司,财务数据更是有着这一阶段公司的典型特征:2018-2019年Poseida的净亏损分别达4440万美元和8650万美元;截至2020年3月31日,该公司拥有1.034亿美元的现金和2920万美元的总债务。
Poseida财务状况(资料来源:招股书)
该公司首次提交纳斯达克上市申请是在2019年1月,当时计划募资1.15亿美元。不过到了2019年4月,其就放弃了上市计划,用公司首席执行官Eric Ostertag的话说,“如果不是因为政府停摆,该IPO会按计划推进。”
但就在这一月份,Poseida 宣布完成了1.42亿美元C轮融资。该轮融资由诺华领投,其出资7500万美元,持股比例为14.9%,此外公司原有投资者Malin Corporation、Longitude Capital等也同样参与了此轮融资。
到2020年6月,Poseida公司完成1.1亿美元D轮融资后,成立六年来其已累计实现超3亿美元的融资金额。
而Poseida 搁置一年的上市计划也同步启动了。2020年6月19日,Poseida向美国证券交易委员会提交了上市申请文件,拟筹集1.15亿美元的首次公开募股,至今这一目标金额为1.5亿美元。
对于最新D轮募得的资金和IPO潜在募资,Poseida则表示将用于推动公司主要候选产品的临床开发,以及支持公司的专有基因工程平台以开发更多的细胞和基因疗法产品。
这些核心平台技术可在多种细胞和基因治疗模式中单独或组合使用,使公司能够设计出自己的全系列候选产品,以克服当前细胞和基因治疗的主要局限。从研发管线来看,Poseida目前拥有10款在研产品,其中有8款聚焦在CAR-T细胞疗法领域,以下为该公司目前主要候选产品的具体情况:
Poseida在研管线(资料来源:公司官网)
在BCMA-CAR-T这一赛道,目前蓝鸟和传奇生物较为领先,两家均预计将在今年第三季度向美国FDA提交BLA申请。此外,目前国内外包括GSK、安进、再生元、信达生物、科济生物等等也都在布局BCMA-CAR-T赛道,这一细分领域的竞争可谓激烈。
据悉,其与早期靶向BCMA的CAR-T疗法相比,P-BCMA-101最大的不同是通过非病毒方式对患者自体细胞进行基因编辑。该疗法基于Poseida的piggyBac平台非病毒载体技术开发,能够使得CAR-T产品候选物具有高比例的干细胞记忆T细胞(TSCM),这是唯一一种自我更新和长寿命的T细胞。2019年5月,P-BCMA-101获得FDA批准的孤儿药认定。
“P-BCMA-101在1期临床试验中表现出了更高的疗效,毒性率极低。”Eric Ostertag在一份新闻稿中表示。
从Poseida 此前公布的P-BCMA-1011期临床研究成果来看,该疗法在试验中表现出持续的良好的耐受性,只观察到两例轻度和瞬时的细胞因子释放综合征(CRS),以及一例可能出现神经毒性的患者,其剂量均低于计划的第二阶段剂量。而截至2018年11月,在国际骨髓瘤工作组(IMWG)标准可评估的19名患者中,15名患者表现出有意义的应答,3名接受过计划第二阶段剂量的可评估患者,客观反应率(ORR)为100%。
接下来,Poseida 预计将在2020年底前发布P-BCMA-1011的临床数据更新。
今年5月22日,Poseida 宣布P-PSMA-101已经完成首位患者给药,用于评估其对转移性去势抵抗前列腺癌患者的影响。此次试验是一项开放标签、多中心、计量递增的I期临床研究,受试者将接受单次或多剂量P-PSMA-101,研究的目的是确定最少副作用下的最佳计量。
总的来看,以独具特色的平台和技术为支撑,Poseida开发了系列差异化的CAR-T疗法,同时其先导药物BCMA-CAR-T在安全性等方面也已显示出特有优势和一定的竞争力。
当下,在刚刚获得融资后不久就宣布重启IPO计划,表明了Poseida进入资本市场的决心,同时这也意味着公司的发展进入关键时期。接下来,Poseida上市历程将如何,资本又将怎样进一步助力其在CAR-T疗法上的进展与布局,我们也将继续保持关注。
迄今为止,大多数CAR-T疗法都是基于病毒制造产生,通常存在安全性、有限的遗传装载量等固有问题。由于其独特的性质,TSCM细胞相比早期的CAR-T产品,具有增加治疗反应持续时间的能力,可能允许再反应并导致更缓慢地生产TEFF细胞,从而降低毒性并使得能够在没有重症监护病房的情况下进行治疗。
非病毒piggyBac平台不使用病毒载体,而是将CAR分子基因通过质粒载体传递给T细胞,解决病毒载体对患者安全性、运载基因能力有限、终端T细胞过于成熟等问题。
这种方法最显着的优势是它具有生成高百分比TSCM细胞的CAR-T产物的能力,从而细胞体内持续更久且毒性更低。与上一代产品相比,非病毒方法明显降低了制造成本,缩短了制造时间。



文章评论(0)