3款新药被CDE纳入拟优先审评,来自拜耳、武田、璎黎药业
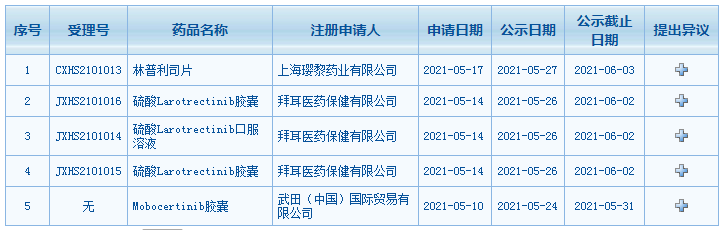
5月27日,根据国家药品监督管理局药品审评中心(CDE)官网最新公示,璎黎药业的林普利司片、拜耳的硫酸Larotrectinib胶囊和口服溶液、武田的Mobocertinib胶囊3种药物的上市申请已被纳入拟优先审评名单。
截图自CDE
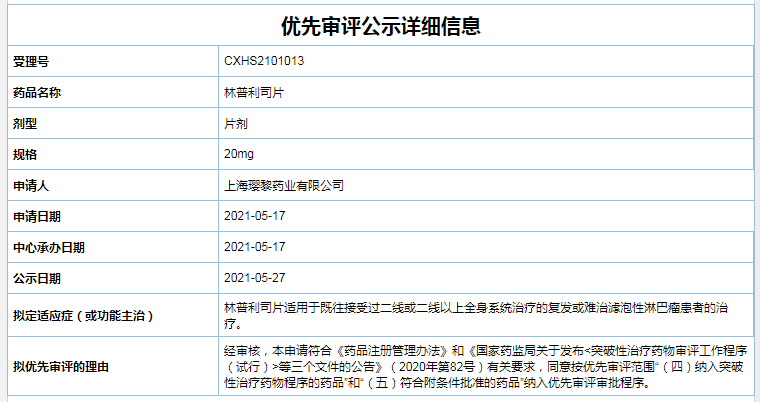
一、林普利司片
拟用于:既往接受过二线或二线以上全身系统治疗的复发或难治滤泡性淋巴瘤患者
公司:璎黎药业
截图自CDE
林普利司是璎黎药业研发的新一代PI3Kδ(磷酯酰肌醇3-激酶亚型δ)高选择性抑制剂,其中PI3K通路参与细胞的生长、存活和代谢,其失调在淋巴瘤的发生发展中起着重要作用。林普利司已在中国和美国开展了多项临床试验,且已有的临床数据显示该药物疗效显著,同时具有良好的安全性。其中,林普利司在89例(可评估病例)复发/难治滤泡性淋巴瘤的患者中,总缓解率(ORR)达80%以上,疾病控制率(DCR)达95%以上。
目前,国内尚未有获批上市的PI3Kδ抑制剂。2020年9月,璎黎药业的林普利司用于治疗复发和/或难治滤泡性淋巴瘤的上市申请已被CDE纳入突破性治疗品种,有望成为国内滤泡淋巴瘤临床治疗的首选药物。
此外,FDA已授予林普利司片用于滤泡淋巴瘤和慢性淋巴细胞白血病的两项孤儿药资格认定。
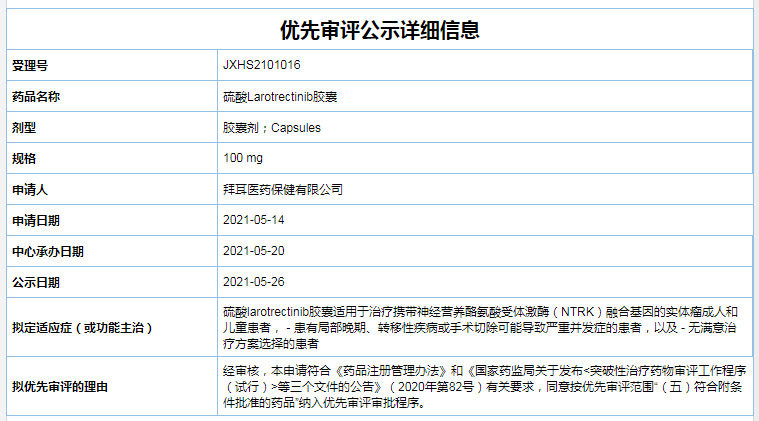
二、硫酸Larotrectinib胶囊和口服溶液
拟用于:携带神经营养酪氨酸受体激酶(NTRK)融合基因的实体瘤成人和儿童患者,包含患有局部晚期、转移性疾病或手术切除可能导致严重并发症的患者,以及无满意治疗方案选择的患者
公司:拜耳
截图自CDE
Larotrectinib是拜耳公司与Loxo Oncology开发的新一代具备高度特异性的口服TRK抑制剂,能够高选择性地结合NTRK融合基因编码的蛋白产物,阻断下游信号通路的激活和传递,从而抑制存在此类突变的癌细胞生长和增殖,以发挥抗癌作用。
截至目前,Larotrectinib已在国内申报3项上市申请,包含100mg、25 mg的胶囊规格,以及20 mg/ml的口服溶液规格,且均可用于携带神经营养酪氨酸受体激酶(NTRK)融合基因的实体瘤成人和儿童患者。
现有数据表明,患者经Larotrectinib治疗后,在TRK基因融合癌症成人患者中,客观缓解率(ORR)为71%,完全缓解率为10%;脑转移患者中ORR为71%,其中10例患者为部分缓解。
2018年11月,FDA加速批准 larotrectinib(拉罗替尼)上市,用于治疗携带NTRK基因融合的成年和儿童局部晚期或转移性实体瘤患者,成为首个针对NTRK 融合突变的靶向药。此外,由于Larotrectinib针对的是特定基因突变,与肿瘤发生的部位无关,因此被称为“广谱抗癌药”。
三、Mobocertinib胶囊
拟用于:既往接受过化疗且携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者
公司:武田
截图自CDE
Mobocertinib是一种强效小分子酪氨酸激酶抑制剂(TKI),能够有针对性地靶向作用于表皮生长因子受体(EGFR)和人表皮生长因子受体-2(HER2)20号外显子插入突变。
现有临床数据显示,在一项针对携带EGFR外显子20插入突变、且既往接受过全身化疗的局部晚期或转移性NSCLC患者的1/2期临床研究中,患者经Mobocertinib治疗后中位无进展生存期(PFS)达到7.3个月,总缓解率(ORR)达到43%。
2019年,Mobocertinib获得FDA孤儿药认证,用于治疗伴HER2突变或EGFR突变(包括外显子20插入突变)的肺癌患者;2020年4月,FDA授予Mobocertinib突破性疗法认定,用于治疗在接受含铂化疗后疾病进展的EGFR外显子20插入突变的非小细胞肺癌患者;2020年9月,Mobocertinib被CDE纳入突破性治疗,用于先前已接受过至少一种全身化疗的伴EGFR外显子20突变的局部晚期或转移性NSCLC患者治疗。



文章评论(0)