阿斯利康“装甲”CAR-T瞄准实体瘤
Abecma
Abecma用于既往接受4线及以上的复发或难治性多发性骨髓瘤的成年患者,包括一种免疫调节剂、一种蛋白酶体抑制剂和一种抗CD38单克隆抗体。
Breyanzi
用于治疗患有大B细胞淋巴瘤(LBCL)的成人患者,包括未指明的弥漫性大B细胞淋巴瘤(DLBCL)(包括由非良性淋巴瘤引起的DLBCL)、高级别B细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤和3B级滤泡性淋巴瘤,包括一线化疗与免疫治疗的难治性患者或一线化疗免疫治疗后12个月内复发;一线化疗免疫治疗的难治性患者或一线化疗免疫治疗后复发,并因合并症或年龄而不符合造血干细胞移植(HSCT),不适用原发性中枢神经系统淋巴瘤患者。
Carvykti
适用于接受过四线及以上后复发或难治性多发性骨髓瘤成年患者。
Kymriah
适用于既往接受两线及以上系统治疗后复发或难治性(r/r)大B细胞淋巴瘤成年患者,25 岁以下复发或难治性急性淋巴细胞白血病 (ALL) 患者,治疗复发或难治性滤泡性淋巴瘤成年患者。
Tecartus
适用于复发或难治性套细胞淋巴瘤患者、复发或难治性 B 细胞前体急性淋巴细胞白血病 (ALL) 成年患者。
Yescarta
适用于既往已接受2种或2种以上系统疗法的复发性或难治性弥漫性大B细胞淋巴瘤(DLBCL)和原发纵隔B细胞淋巴瘤(PMBCL)成人患者,三线或以上系统治疗后的复发性或难治性(R/R)滤泡性淋巴瘤(FL)成人患者,一线化疗免疫疗法难治或一线化疗免疫疗法后12个月内复发的大B细胞淋巴瘤(LBCL)成年患者。
虽然CAR-T在实体肿瘤领域仍然在上下求索之中,但针对实体肿瘤的CAR-T临床研究已经在数量上大幅度提升,去年有将近70项针对实体瘤的临床研究正在进行(图1),实现着从“积跬步”到“至千里”的量变积累。
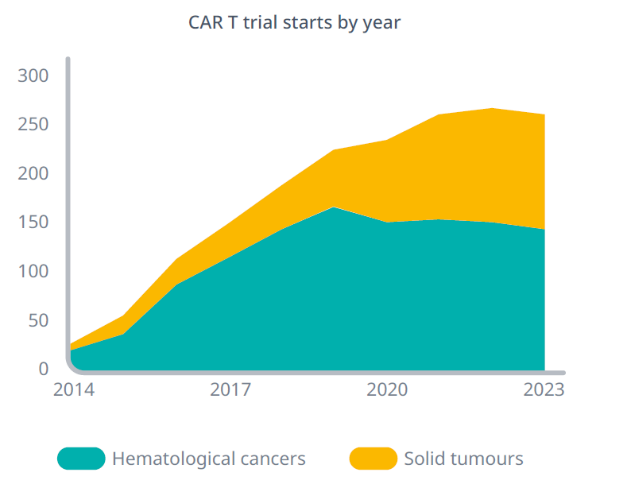
图1. 血液癌症和实体瘤细胞与基因临床研究数量逐年走势图。
(图片来源:IQVIA)
C-CAR031是阿斯利康与中国生物技术公司 AbelZeta 合作开发的GPC3 蛋白靶向疗法。这种疗法采用一种新型“装甲”结构,使得“画地为牢”的实体肿瘤细胞变得不再那么有恃无恐。浙江大学医学院介绍了一项由中国研究人员发起的研究的早期结果,该研究显示C-CAR031疗法具有强烈的反应、持久性以及良好的安全性和耐受性。
24 名接受过大量治疗的肝细胞癌 (HCC) 患者的报告显示,总体反应率高达 56%。91% 的患者肿瘤缩小,肿瘤大小中位数缩小了 44%,肝脏和身体其他部位的病变缩小。在最高剂量水平下,八名患者中有六名有反应。此外,这些反应是持续的,反应持续时间中值为 7.4 个月,中位总生存期尚未达到(也就是说在研究期间,超过一半的患者仍然存活,所以无法计算出中位总生存期)。
安全性方面,C-CAR031也给出了较好的表现,没有剂量限制性毒性(在所测试的剂量范围内没有导致严重到需要停止增加剂量的毒性反应)。虽然出现了高水平的 3 级以上淋巴细胞减少症 (100%)、中性粒细胞减少症 (71%)、血小板减少症 (38%) 和 ALT 升高 (17%),但这些都是可逆的。
肿瘤微环境
实体瘤的微环(TME, tumor microenvironment)复杂,包括抑制性免疫细胞、抑制性细胞因子和代谢产物,这些因素可以抑制CAR-T细胞的功能和存活。肿瘤微环境中的低氧(缺氧)和高代谢需求也会影响CAR-T细胞的活性。
肿瘤抗原的异质性
实体瘤往往有多种不同的抗原表达,而CAR-T细胞通常是针对单一抗原设计的。肿瘤细胞可以通过改变或丢失目标抗原来逃避CAR-T细胞的攻击。肿瘤内和肿瘤间的异质性使得找到一个普遍适用的靶点更加困难。
CAR-T细胞的浸润和渗透
CAR-T细胞需要成功穿透实体瘤的致密基质并在肿瘤内部扩散才能有效杀死肿瘤细胞。然而,实体瘤的基质(如细胞外基质和纤维化组织)会阻碍CAR-T细胞的渗透。
靶向安全性问题
实体瘤靶抗原可能在正常组织中也有表达,导致“脱靶”效应,损害正常细胞和组织,造成严重的副作用。确定特异性高的靶抗原非常关键,但也是一大挑战。
持久性和衰竭
在实体瘤中,CAR-T细胞往往会因为持续的抗原刺激和肿瘤微环境的压力而快速衰竭,失去杀伤能力。提高CAR-T细胞的持久性和防止衰竭是一个重要的研究方向。
免疫抑制分子
实体瘤经常分泌多种免疫抑制分子,如PD-L1、TGF-β等,这些分子能够抑制CAR-T细胞的功能。
综合以上因素,虽然CAR-T细胞疗法在血液瘤(如白血病和淋巴瘤)中取得了显著的成功,但在实体瘤中的应用仍面临许多挑战。
因为GPC3在大多数肝细胞癌症患者中过度表达,因此成为了很多疗法开发的靶标,包括赛诺菲的 T 细胞接合剂和 Eureka Therapeutics 的 T 细胞疗法(均处于 II 期阶段)。另一种针对 GPC3 的 CAR-T来自于开发中的Noile-Immune Biotech 的 NIB102,但其 ASCO 报告显示,在 I 期研究中仅有一次反应,合作伙伴武田也于去年退出了合作。
阿斯利康一直在寻找克服 CAR-T 持久性和安全性问题的手段。C-CAR031采用转化生长因子β 受体 II (TGFβRII)“装甲”技术。TGF-β(转化生长因子β)在肿瘤微环境中具有高度免疫抑制作用,会抑制免疫细胞的功能,帮助肿瘤逃避免疫系统的攻击。通过“装甲”技术,C-CAR031能够对抗这种抑制作用,从而提高疗效。对于实体瘤的细胞疗法来说,这些结果令人鼓舞。T 细胞一旦注入患者体内,就会迅速而广泛地扩增,并且具有持久性,这对于“坚壁清野”的实体瘤细胞具有提升的打击效应。
TGFβRII“装甲”是指在CAR-T细胞疗法中采用的一种策略。在这种策略中,CAR-T细胞被修改以表达转化生长因子β受体II(TGFβRII)的显性负效应(dn)形式。这种形式的TGFβRII可以阻断TGF-β信号传导,从而减轻TGF-β所带来的免疫抑制效应,保护 CAR-T 细胞免受这种细胞因子的免疫抑制作用。这种装甲策略可以增强CAR-T细胞的抗肿瘤活性,使其能够更有效地攻击肿瘤细胞而不受TGF-β信号通路的抑制。
阿斯利康开发的装甲技术正在用于另外两个实体肿瘤项目:AZD0754,针对前列腺癌中的 STEAP2试验,目前正在进行I/II 期招募;AZD4622,针对胃癌和胰腺癌中的 Claudin 18.2研究。
Ref.
McConaghie, A. ASCO: AstraZeneca Achieves Eye-Catching Solid Tumor Results With 'Armored' CAR-T. Scrip. 06. 06. 2024.
Guzman, G. et al. CAR-T Therapies in Solid Tumors: Opportunities and Challenges. Curr Oncol Rep. 2023. 25, 479-489.
McConaghie, A. AstraZeneca Targets $80bn Sales By 2030 But Analysts Still To Be Convinced. Scrip. 22. 05. 2024.


文章评论(0)