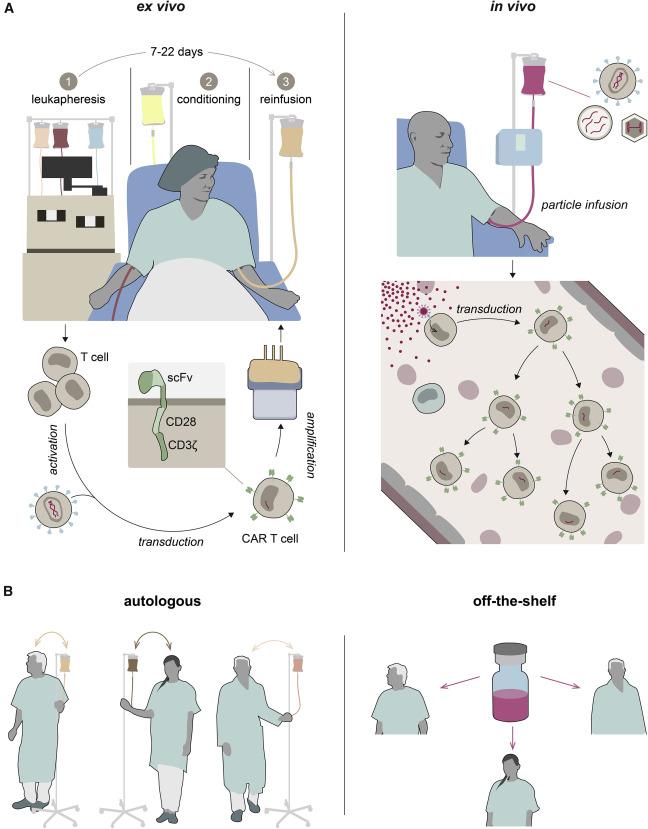
体内CAR-T:CAR-T疗法的未来
自 2017 年以来,FDA 已批准了六种用于治疗血癌的自体 CAR-T 细胞疗法。治疗需要一个多步骤的过程,即从患者身上采集T细胞,对它们进行重新编程以发现和破坏癌细胞,然后繁殖和重新输注它们。由于生产过程缓慢和产能瓶颈,一些患者在治疗到达之前就死亡了,并且质量参差不齐,具体取决于提取细胞的健康状况。患者在输注前接受化疗以消除现有的 T 细胞,这为新细胞提供了新的空间,但增加了并发症的可能性,包括危及生命的感染。
体内CAR-T (in vivo CAR-T) 细胞疗法可能会改变全球市场的游戏规则,CAR-T市场预计到2032年将达到885亿美元的规模。这项研究技术避开了外部制造,使用基因载体来修改体内的免疫细胞。可以消除自体CAR-T和现成的同种异体疗法的许多缺点,使细胞疗法能够惠及更多的患者和新适应症,包括自身免疫性疾病,在这些适应症中,它已显示出巨大的前景。
(图片来源:Molecular Therapy)
人们越来越关注使用CAR-T疗法来治疗自身免疫性疾病,例如狼疮。这些疾病是由错误地攻击健康组织的免疫系统故障引发的。CAR-T在一些患者中显示出惊人的效果,可以消除这种免疫系统攻击,使疾病进入无药物缓解期。然而鉴于CAR-T疗法内在的高风险,这类疗法通常只针对肿瘤疾病,而自免疫患者使用CAR-T疗法可能会面临较差的风险效益比。体内CAR-T 疗法的开发则可能令广大的自免疫疾病患者受到这种先进疗法的恩泽。
Capstan Therapeutics则在开发体内CAR-T的自免疫疾病疗法,希望突破CAR-T只针对肿瘤患者的樊笼。Capstan的体内CAR-T疗法CPTX2309针对的就是自身免疫候选药物,该疗法最近在B轮融资中获得了1.75亿美元。
体内CAR-T还可以提高治疗的可及性,使得大量无法企及CAR-T疗法的患者受到恩泽。目前美国只有20%的医院提供自体CAR-T疗法,这意味着绝大多数患者只能望洋兴叹。与之相对,体内治疗可以在医院或配送中心制造和储存,并且可能更容易管理,从而惠及更多患者。
体内CAR-T面临众多挑战,包括工程病毒和合成遗传物质等治疗成分的大规模生产。包括Ensoma和Exuma Biotech在内的少数几家初创公司正在使用慢病毒或腺相关病毒等基因载体以及脂质纳米颗粒等非病毒平台测试体内CAR技术。
Capstan的递送方法使用类似于COVID-19疫苗中使用的脂质纳米颗粒,可能比使用腺相关病毒载体的公司更具优势,但存在潜在的安全问题。在体内使用AAV可能对肝脏或大脑有毒,并可能导致血栓性微血管病。安全性是体内CAR-T疗法开发的关键, CAR-T常见的不良事件包括神经毒性和细胞因子释放综合征。开发人员还需要防止脱靶转导,确保只有靶细胞受到影响。
2025年将成为体内CAR-T技术发展的关键一年,一些数据将会在这一年呈现,昭示这项技术的未来。
Ref.
CAR-T-Cell Therapy Market is Rising Rapidly at CAGR 29.8% by 2032. Biospace. 15. 03. 2024.
Capstan Therapeutics Announces $175M Oversubscribed Series B Financing. Businesswire. 20. 03. 2024.
Michels, A. et al. Precision medicine: In vivo CAR-Therapy as a showcase for receptor-targeted vector platforms. Mol Ther. 2022 Jul 6;30(7):2401-2415. doi: 10.1016/j.ymthe.2022.05.018.


文章评论(0)