多抗:下一个大药发展趋势
例如,双特异性T细胞衔接抗体能提高肿瘤清除率,多特异性抗体通过联合调控免疫系统减少免疫逃逸,突破传统疗法瓶颈。
为克服单抗药物的局限性,多特异性抗体的开发成为了生物制药领域的重要方向。多特异性抗体能够同时识别并结合多个靶点,赋予其更强的治疗潜力,特别是在处理复杂疾病时表现尤为突出。
多特异性抗体能同时靶向多个分子或细胞,增强治疗效果,特别是在癌症治疗中,提高肿瘤清除率,减少免疫逃逸。它们通过作用于多个靶点,降低疾病产生耐药的机会,并结合不同免疫细胞,激活多条免疫通路,有效防止肿瘤复发。多特异性抗体还能增强免疫细胞活性,全面激活免疫系统抗肿瘤效应。此外,它们的设计具有高度灵活性,可根据疾病需求进行靶点选择,实现个性化精准治疗,充分发挥在复杂疾病治疗中的潜力。
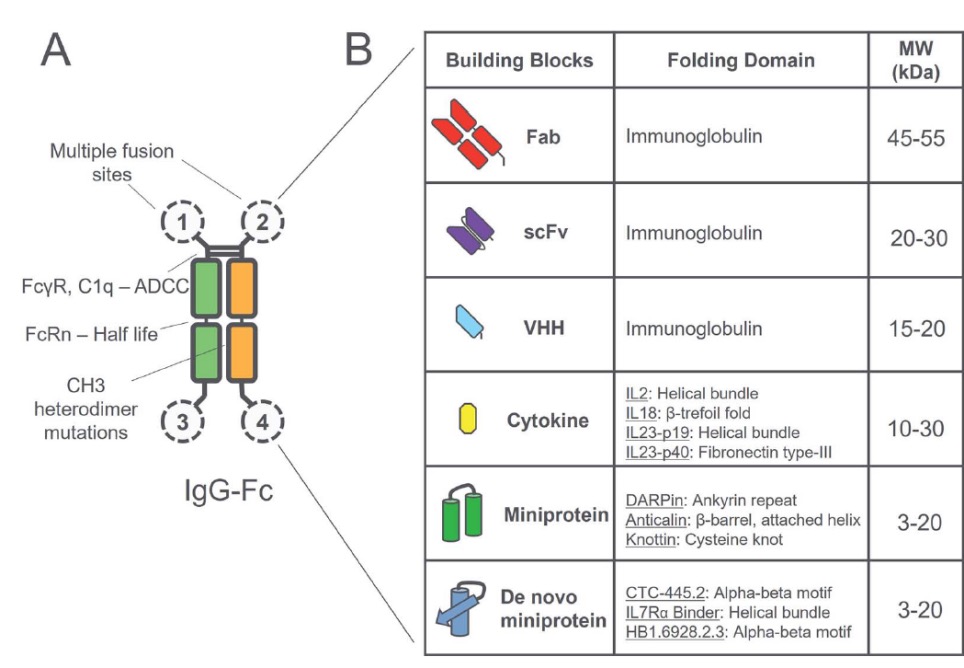
(图片来源:Antibody Therapeutics)
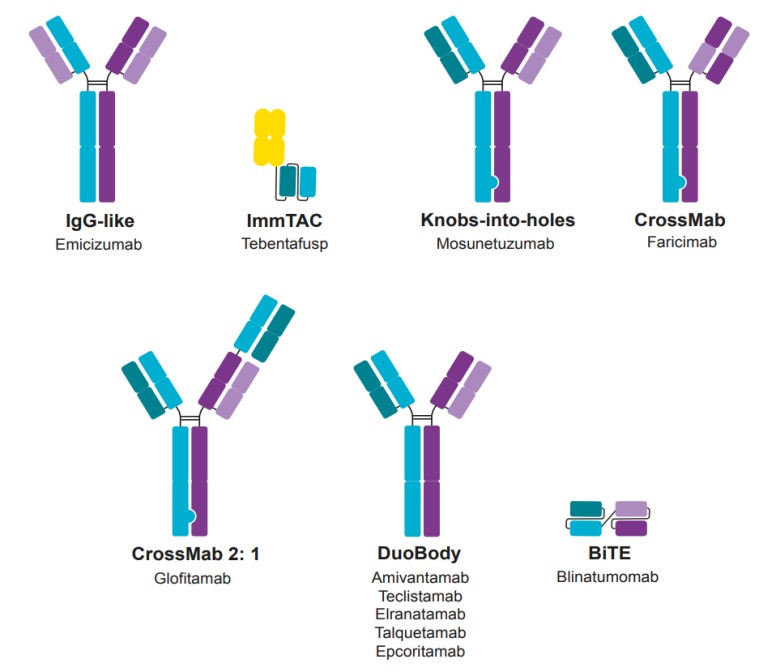
(图片来源:Revvity)
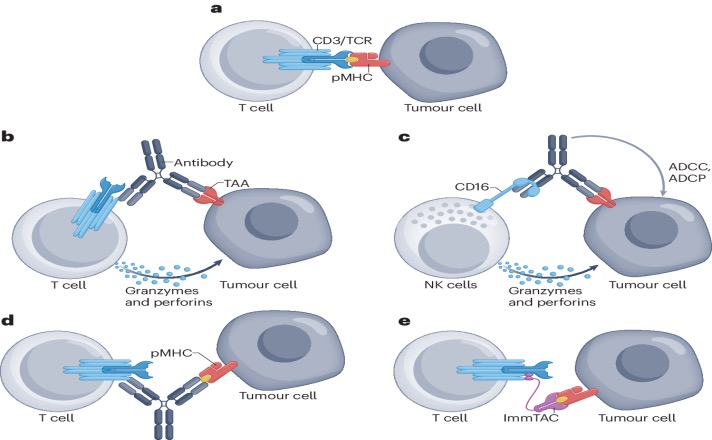
TAA(肿瘤相关抗原)可以来自多种来源,可以是细胞表面的蛋白质,也可以是来源于细胞内蛋白质的肽段,这些肽段通过主要组织相容性复合体(MHC)呈递到细胞表面。当这些肽段与MHC结合并在细胞表面呈递时,T细胞(特别是CD8+细胞毒性T细胞)可以识别这些肽段,从而对肿瘤细胞产生免疫反应。
肿瘤特异性抗原 (TSA) 仅由肿瘤细胞表达,在个体之间甚至同一患者的不同转移灶之间可能存在很大差异。肽-MHC 复合物 (pMHC) 是肿瘤细胞表面 MHC I 受体中呈递给 T 淋巴细胞的癌症特异性表位。使用免疫动员抗肿瘤单克隆T细胞受体(ImmTAC)可以识别 pMHC。
重要的是,使用双特异性抗体同时抑制CTLA-4和PD-1有潜力模拟这种协同效应,从而恢复T细胞对肿瘤细胞的效应免疫反应,并在TME中消耗调节性T细胞(Treg)。例如康方生物的cadonilimab就是一种同时结合PD-1和CTLA-4的双特异性抗体,这两种受体在肿瘤浸润淋巴细胞(TILs)中共表达。Cadonilimab同时靶向它们可以增强肿瘤部位的免疫活性,并已在中国获得临床使用批准。针对多种抑制性免疫检查点的双特异性抗体靶向的受体包括PD-(L)1, CTLA-4, LAG-3,TIM-3和TIGIT。
与促炎性细胞因子相反的是,免疫抑制性细胞因子(例如如TGFβ)可以抑制抗肿瘤免疫,促进肿瘤细胞的可塑性,使得肿瘤持续进展。Bintrafusp alfa是一种新型的抗PD-L1/TGFβ受体II融合蛋白,同时抑制PD-1/PD-L1介导的免疫抑制,并且减少肿瘤微环境中的TGFβ水平。
· Blinatumomab(Blincyto,安进)于2014年获批用于治疗复发或难治性急性淋巴细胞白血病。Blinatumomab是一种双特异性T细胞接合抗体(BiTE),可结合癌细胞上的CD19,并通过结合CD3招募T细胞。
· Amivantamab(Rybrevant,强生)于2021年获批用于治疗转移性非小细胞肺癌。Amivantamab是一种duobody,可结合癌细胞上的表皮生长因子受体(EGFR)和c-Met,阻断下游生长和信号传导,并通过其Fc结构域与免疫细胞上的CD16结合,诱导免疫细胞介导的细胞毒性。
· Tebentafusp(Kimmtrak,Immunocore)于2022年获批用于治疗转移性葡萄膜黑色素瘤。Tebentafusp是一种可溶性TCR/scFv融合蛋白,或称为ImmTAC,能够结合癌细胞上由HLA(HLA-A*02:01)呈现的gp100肽,并通过结合CD3招募T细胞。
· Mosunetuzumab(Lunsumio,Genentech)于2022年获批用于治疗复发或难治性滤泡性淋巴瘤。Mosunetuzumab是一种“knobs-into-holes”结构的双特异性抗体,能够结合癌细胞上的CD20,并通过结合CD3招募T细胞。
· Elranatamab(Elrexfio,辉瑞)于2023年获批用于治疗复发或难治性多发性骨髓瘤。Elranatamab能够结合癌细胞上的BCMA,并通过结合CD3招募T细胞。
· Talquetamab(Talvey,强生)于2023年获批用于治疗复发或难治性多发性骨髓瘤。Talquetamab能够结合癌细胞上的GPRC5D,并通过结合CD3招募T细胞。
· Glofitamab(Columvi,Genentech)于2023年获批用于治疗复发或难治性弥漫性大B细胞淋巴瘤。Glofitamab是一种CrossMab,能够结合癌细胞上的CD20,并通过结合CD3招募T细胞。
· Epcoritamab(Epkinly,艾伯维)于2023年获批用于治疗复发或难治性弥漫性大B细胞淋巴瘤和高级别B细胞淋巴瘤。Epcoritamab能够结合癌细胞上的CD20,并通过结合CD3招募T细胞。
还有两种双特异性抗体被批准用于非癌症类疾病:
· Emicizumab(Hemlibra,Genentech)于2017年获批用于治疗A型血友病。Emicizumab是一种类IgG的双特异性抗体,能够替代A型血友病患者缺乏的凝血因子VIII,通过结合和连接凝血因子IXa和X发挥作用。
· Faricimab(Vabysmo,Genentech)于2022年获批用于治疗新生血管性老年黄斑变性、视网膜静脉阻塞和糖尿病性黄斑水肿。Faricimab是一种CrossMab双特异性抗体,能够结合并中和Ang-2和VEGF-A。
虽然癌症是迄今为止的主要治疗焦点,但多特异性抗体也逐渐扩展到了其他适应症,包括感染(HIV、COVID-19、乙型肝炎和人巨细胞病毒)、自身免疫性疾病(如类风湿性关节炎)、血管疾病(如动脉粥样硬化),以及神经退行性疾病(如阿尔茨海默病)。
多特异性抗体作为新一代生物治疗工具,展现了巨大的前景。凭借其同时靶向多个分子或细胞的能力,多特异性抗体可以在复杂疾病中发挥更精准和多维的治疗作用。尤其是在癌症治疗中,它们不仅能增强抗肿瘤免疫反应,还能克服传统单抗的耐药性问题。
此外,随着多特异性抗体在自身免疫性疾病、感染性疾病、神经退行性疾病等领域的探索,未来的治疗领域将更加广泛。随着技术的进步和临床研究的深入,这类抗体有望为难治性和复杂性疾病带来新的治疗方案,并推动个性化和精准医学的发展,成为生物制药领域的下一个创新热点。
根据Precedence Research的数据,2023年全球双特异性抗体市场为86.5亿美元,预计在未来10年内将增长至约4850亿美元。
Daniel, K. et al. Next generation of multispecific antibody engineering, Antibody Therapeutics. 2024, 7, 37–52. https://doi.org/10.1093/abt/tbad027
Goebeler, M. et al. Bispecific and multispecific antibodies in oncology: Opportunities and challenges. Nature Reviews Clinical Oncology. 2024. 21, 539-560. https://doi.org/10.1038/s41571-024-00905-y
Exploring the strengths, challenges, and therapeutic applications of multispecific antibodies. Revvity. Retrieved on 07. 10. 2024.
Goodwin, K. With Myriad Recent Approvals in Cancer, The Era of Bispecifics Is Here. Biospace. 14. 10. 2024.


文章评论(0)