关注 | 由中国罕见病联盟组织撰写的HTA专家共识将在2019年中国罕见病大会上发布
罕见病漏诊误诊率极高,用药难用药贵等问题突出,药物可及性现状不容乐观。
由中国罕见病联盟发起,北京协和医院张抒扬教授与国家卫健委药物与卫生技术综合评估中心副主任赵琨教授作为负责人,共同制定的《罕见病药物卫生技术评估专家共识(2019)》将在”2019年中国罕见病大会”上隆重发布。
中国速度——助力罕见病防控
罕见病(Rare Diseases),顾名思义是发生率较低的疾病,它是全人类共同面临的重大医学难题。党的十八大以来,在以习近平总书记为核心的党中央、国务院的坚强领导下,我国罕见病卫生事业的发展取得了长足进步。“健康中国2030”规划纲要中指出:全民健康是建设健康中国的根本目的,而罕见病人群的健康将是实现这一目的不可忽视的部分。
由于罕见病发病率极低、单病种患病人数少,且具有病种繁多、遗传为主、诊治困难等特点,罕见病药物研发困难且需要巨大的成本投入,所以罕见病药物种类稀缺、价格昂贵,常常被称为孤儿药(Orphan Drugs)。目前,全世界范围内只有不足5%的罕见病患者接受了有效治疗。
近年来,国家推出了一系列政策激励罕见病研究和孤儿药研发。2018年5月,国家卫生健康委员会等五部委联合发布首批国家罕见病目录。《中国第一批罕见病目录》和国内首部《罕见病诊疗指南(2019年版)》的发布,为疾病诊疗规范、药物政策、医保救助政策等相关工作提供了有效的参考和依据。
以此为契机,中央政府各部委在加快罕见病药物审评审批及上市、部分罕见病药物减税、临床急需境外新药进口遴选等方面出台相应政策,各地方政府探索利用大病医疗保险和补充保险制度支持罕见病的治疗并建立专病救助基金和患者援助计划,以提高我国罕见病患者用药可及性。
虽然我国罕见病事业取得了较快发展,但与欧美等其他发达国家相比,我国罕见病的诊疗管理工作起步较晚,在科研、诊疗、权益保障、社会公平等方面仍然存在很多薄弱环节。比如,《第一批罕见病目录》中121种疾病的300多万名罕见病患者,仍然面临诸多难题,包括疾病难以诊断、疾病诊断后无药可治、治疗药物未在中国上市或无罕见病适应症、治疗药物虽已上市但价格高昂未纳入医保等。罕见病药物的不可及与不可负担是横亘在患者面前最大的障碍。
中国智慧——凝结罕见病专家共识
打通孤儿药的注册审批、医保目录准入的通道,是解决药物可及性和可负担性的重要手段。卫生技术评估(Health Technology Assessment, HTA)是一种对卫生技术适宜性、效果和影响进行系统评价的方法,已经作为成熟的评估工具被应用在国内外的医药卫生体系中,可以为药物市场准入及医药卫生决策提供有效和科学的证据。
针对罕见病药物开展卫生技术评估,为国家医疗政策管理、医疗保险准入以及药品审评审批等相关政策决策提供综合、可靠的循证依据,已经成为目前提高我国罕见病诊疗水平、解决罕见病患者核心诉求的重要着力点。但是,由于罕见病具有患者人数较少、疾病异质性高等特点,罕见病药物的卫生技术评估遇到了许多伦理上与技术上的挑战。
除此之外,我国还面临着临床诊疗水平不均、流行病学数据匮乏、医护专业人才不足等现实国情。因此,在借鉴国际研究经验的同时,还迫切需要结合我国罕见病诊疗现状与目前的工作基础,制定适应我国国情的罕见病药物卫生技术评估规范,切实指导我国罕见病卫生技术评估研究。
为此,由中国罕见病联盟作为发起方,中国医学科学院北京协和医院张抒扬教授与国家卫健委药物与卫生技术综合评估中心副主任赵琨教授作为负责人,共同制定了《罕见病药物卫生技术评估专家共识(2019)》(以下简称“共识”)。该《共识》邀请了国内卫生经济学、药物经济学、临床药物研究、罕见病药物保障制度、罕见病临床诊疗、医学伦理学、信息学等多个领域的30多位权威专家、学者,耗时将近一年,通过四次全体专家工作讨论会的不断讨论、修订后最终定稿。在没有国际相关专家共识和指南参考的情况下,我国的专家组充分凝聚中国思路与中国智慧,率先发布了中国的《共识》!
《共识》的形成过程是科学、有序、规范的,是全体专家组成员智慧与经验的凝结。《共识》是中国第一本聚焦于罕见病药物HTA研究的专业学术指南,全文共1万2千多字,分为前言、总论、罕见病药物卫生技术评估研究问题的界定、安全性评估、有效性评估、经济性评估以及伦理和社会价值评估,共七个部分;针对其中的关键研究问题提出了近40项专家建议,力求对罕见病药物卫生技术评估的技术要点达到全局考量与全面覆盖。
《共识》将于2019年10月19日在第一届“中国罕见病大会”开幕式主题演讲中,由北京协和医院张抒扬教授代表专家工作组正式对外发布。《共识》专家组也将根据实际政策环境与研究进展,结合未来我国《罕见病目录》的更新与扩充,每2年对《共识》进行一次更新与修订。
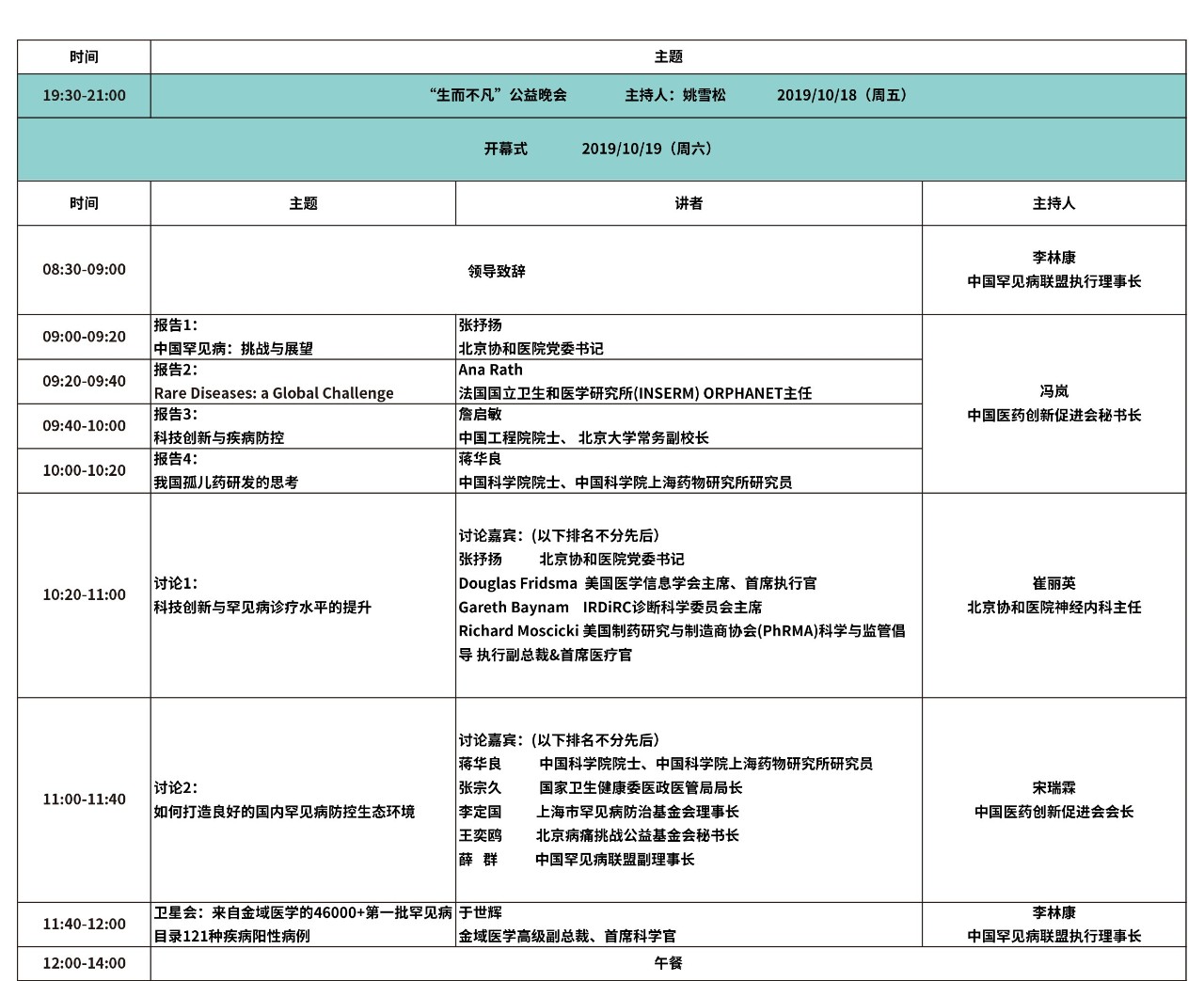
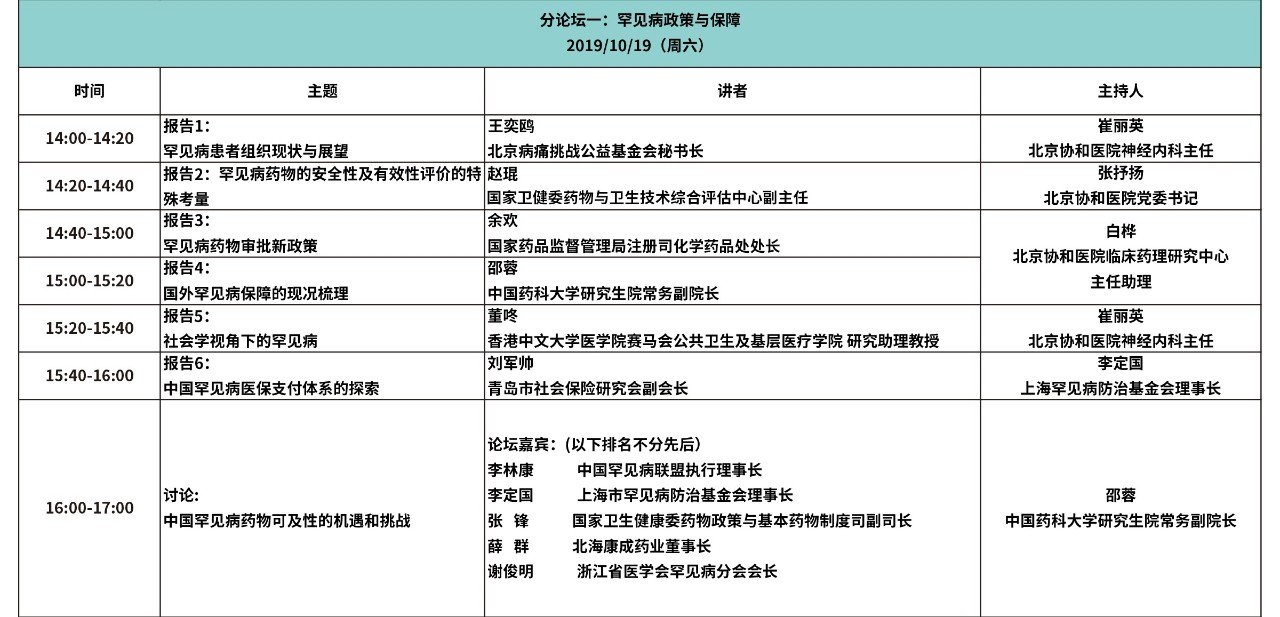
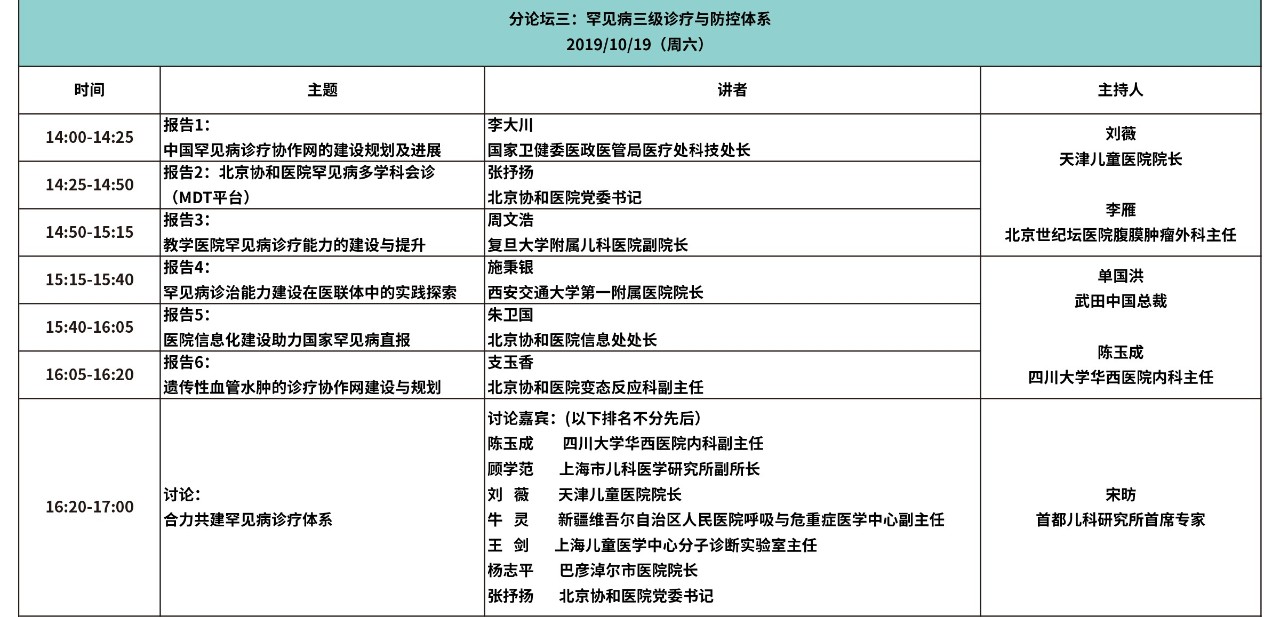
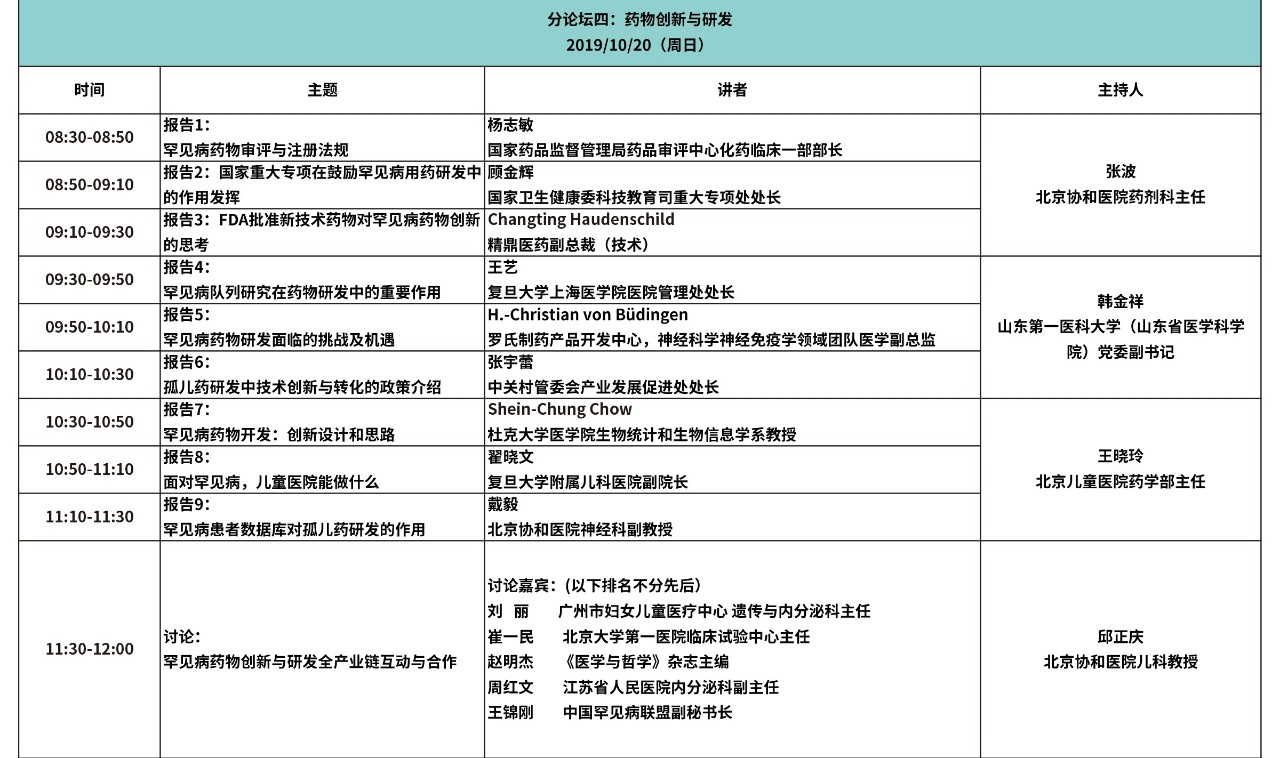
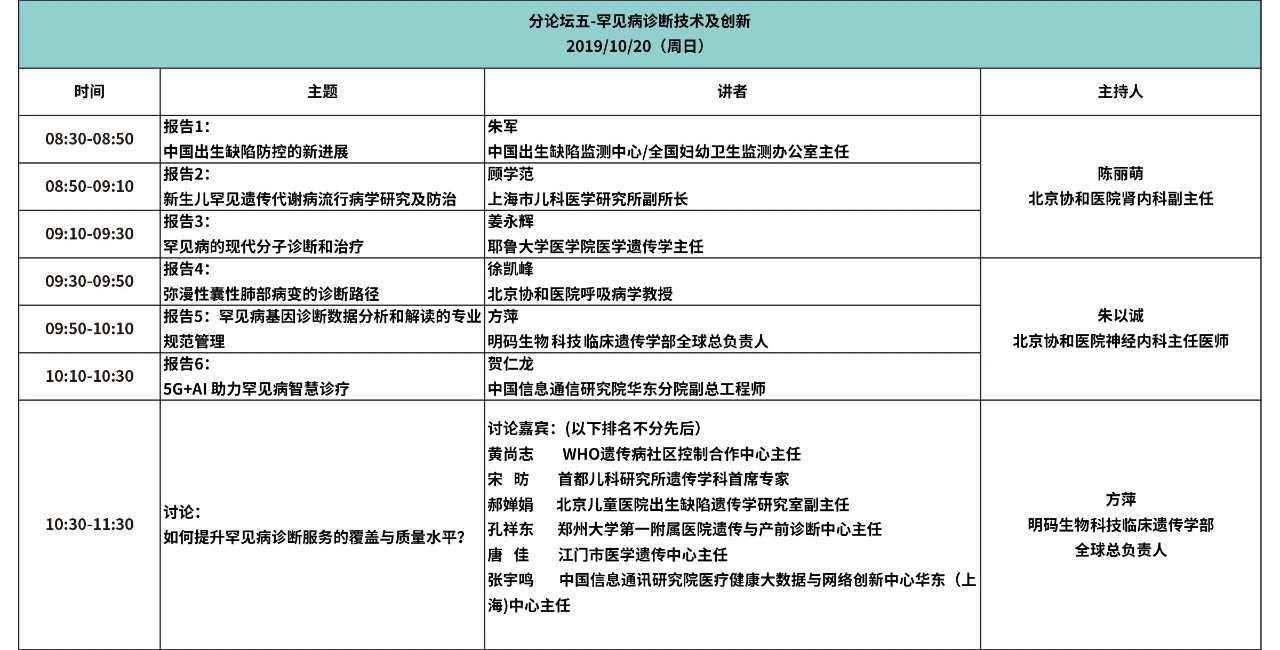
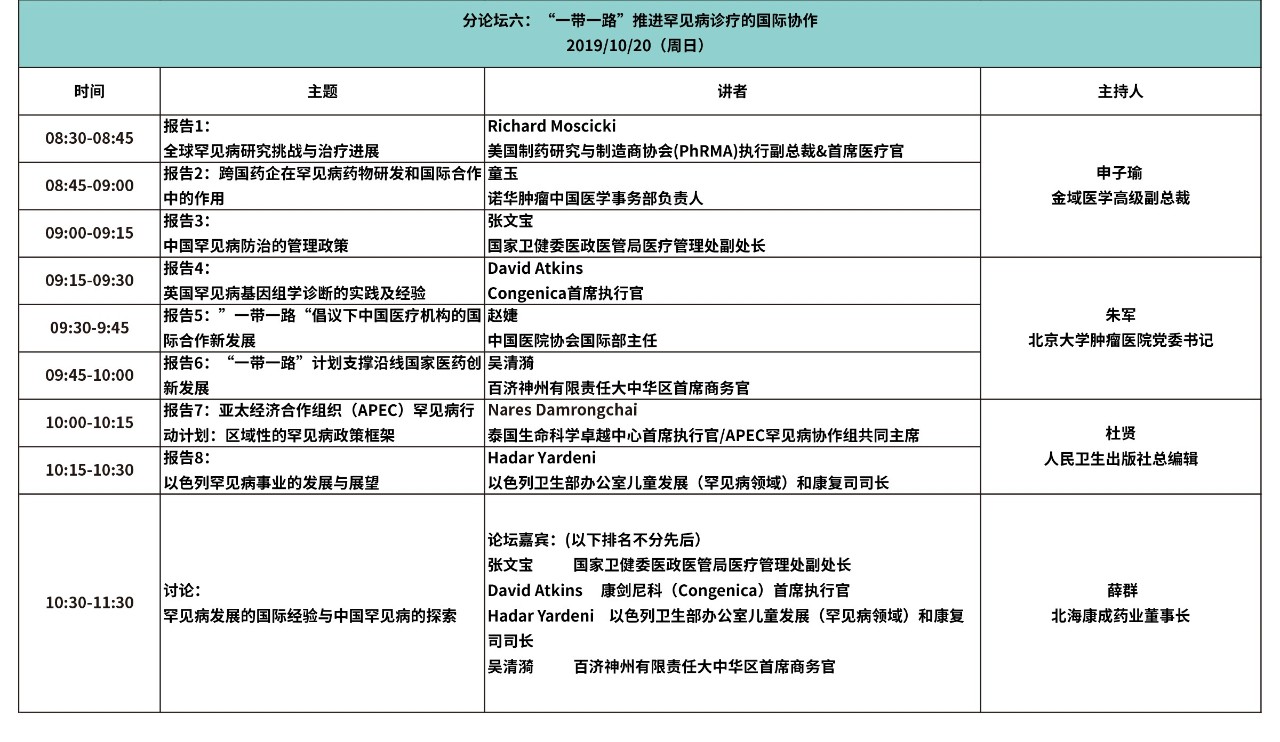
大会日程
(点击图片观看更清晰)




文章评论(0)