CAR-T治疗实体瘤再迈一小步,背后是这家细胞疗法实力“猛将”
近日,有关于“一种新型CAR-T细胞疗法在儿童神经母细胞瘤中显示出良好早期结果”的文章在相关医疗媒体的报道中频频出现:
来自英国大奥蒙德街儿童医院和伦敦大学学院等研究人员在Science Translational Medicine期刊发表的一项研究, 报告了12例神经母细胞瘤儿童患者在接受一种靶向GD2的CAR-T细胞治疗后,结果显示出积极的临床抗肿瘤活性。更重要的是,所有患者的CAR-T细胞没有对表达GD2分子的健康组织造成任何有害的副作用。
这被认为是证明CAR-T细胞对实体瘤实现快速消退的研究之一。“虽然呈现的抗肿瘤活性只是暂时的,但它提供了一个重要的原理验证,即靶向GD2的CAR-T细胞疗法可以用于治疗儿童实体瘤。”论文第一作者,大奥蒙德街儿童医院儿科肿瘤学顾问Karin Straathof博士表示。
AUTO6是以GD2为靶点的CAR-T细胞疗法,拟用于治疗神经母细胞瘤(neuroblastoma,NB)。该疗法 Ⅰ 期临床试验由英国癌症研究中心(CRUK)赞助和开展,初步数据显示其在神经母细胞瘤中具有抗肿瘤活性。
神经母细胞瘤是一种罕见癌症,为胚胎性肿瘤,主要由婴儿在子宫发育过程中留下的特殊神经细胞(神经母细胞)发展而来。目前,对儿童侵袭性神经母细胞瘤的治疗包括手术切除、化疗伴随干细胞移植、放射治疗和抗体治疗等,不过即使经过这些强化治疗,长期生存率也只有50% - 60%。
GD2(去唾液酸神经节苷脂)则是神经母细胞瘤高表达的一种物质,同时也在黑色素瘤、骨骼和软组织肉瘤、小细胞肺癌等多肿瘤中表达。就神经母细胞瘤来说,GD2抗体是针对高危神经母细胞瘤的特效药物,目前全球已有Unituxin、Qarziba和Danyelza三款药物获批上市。在国内,百济神州从EUSA Pharma引进的Qarziba(迪妥昔单抗),也于今年11月提交了上市申请。
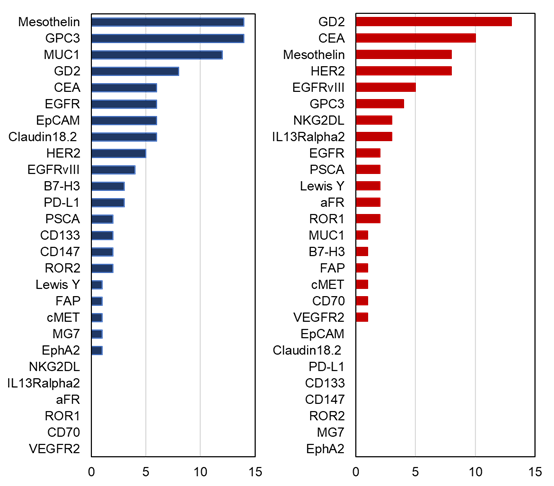
除了抗体药物之外,GD2也是近年来CAR-T治疗实体瘤的主要研究靶点之一。来自Clinicaltrials.gov数据库的一项数据显示,截至2020年7月,按照开展临床试验的数量排序, GD2靶点在国内CAR-T治疗实体瘤的临床试验中排在第四位,在国外更是居首位。
CAR-T治疗实体瘤的靶点分布情况(资料来源:Clinicaltrials)
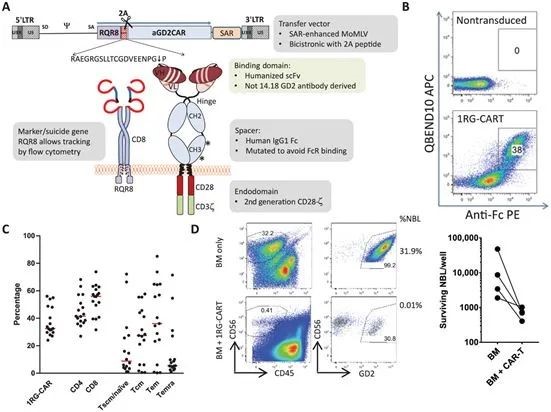
在前文提及的AUTO6 Ⅰ 期临床试验中, 来自英国大奥蒙德街儿童医院和伦敦大学学院等研究人员对患者自身的T细胞进行了CAR修饰,使其靶向GD2表面蛋白,从而能够识别并杀死神经母细胞瘤肿瘤细胞。
GD2 CAR-T细胞设计、表达和功能
12名患有复发或难治性神经母细胞瘤的儿童接受了该疗法。研究结果显示,当使用足够剂量的GD2 CAR-T细胞治疗后,该治疗会诱导部分患者的肿瘤迅速缩小。这些影响虽然比较短暂,但重要的是,在所有患者中修饰过的CAR-T细胞对表达GD2分子的健康组织并未造成任何有害的影响。
“神经母细胞瘤细胞的快速消退是有希望的,特别是这种活性是在没有基于抗GD2抗体产生的神经毒性的情况下产生的。"来自伦敦大学学院癌症研究所的Martin Pule博士认为,利用GD2 CAR-T细胞靶向神经母细胞瘤似乎是一种有效且安全的策略,但也需要进一步改进以提高这些CAR-T细胞的寿命。
这正是Autolus公司候选产品AUTO6NG接下来要做的事情。
实际早在2014年,Autolus就在Syncona基金的支持下从伦敦大学独立出来。Autolus公司CEO Christian Itin博士则曾担任Micromet公司CEO,正是这期间其主持开发了用于肿瘤治疗的双特异性抗体药物Blincyto,该药物可同时识别肿瘤细胞表面的CD19以及T细胞上的CD3分子,并由此促进T细胞识别消灭肿瘤细胞。
Autolus进入大众视野是在其成立的两年之后,其也由此开启了一路“开挂”模式:
1. 2016年,Autolus完成超一亿美元的资金募集,开始被市场所熟知;
2. 2018年4月,Autolus登陆美国纳斯达克资本市场,IPO募资高达1.5亿美元;
3. 2019年4月,Autolus管线中在研药物AUTO3获FDA授予的孤儿药资,拟用于急性淋巴细胞白血病(ALL);
4. 2019年11月,Autolus另一款ALL治疗药物AUTO1也获得了FDA授予的孤儿药资格;
5. 2020年4月,Autolus宣布FDA批准其在研CAR-T产品AUTO1研究新药(IND)申请,用于治疗成人急性淋巴细胞白血病(ALL)。
这一发展势头也引来了媒体的关注。2019年底,知名网站GEN发布《2019全球免疫肿瘤学初创公司TOP10》,Autolus成功上榜并排名第五,此外Biospace网站也将Autolus纳入了《2020年细胞和基因疗法领域值得关注的5家新兴公司》榜单。
不过作为一家新兴生物技术公司,Autolus的野心却并不小:开发出比如今已经上市的或处于申请阶段的CAR-T疗法更安全有效的新一代疗法,用于治疗血液瘤以及实体瘤。
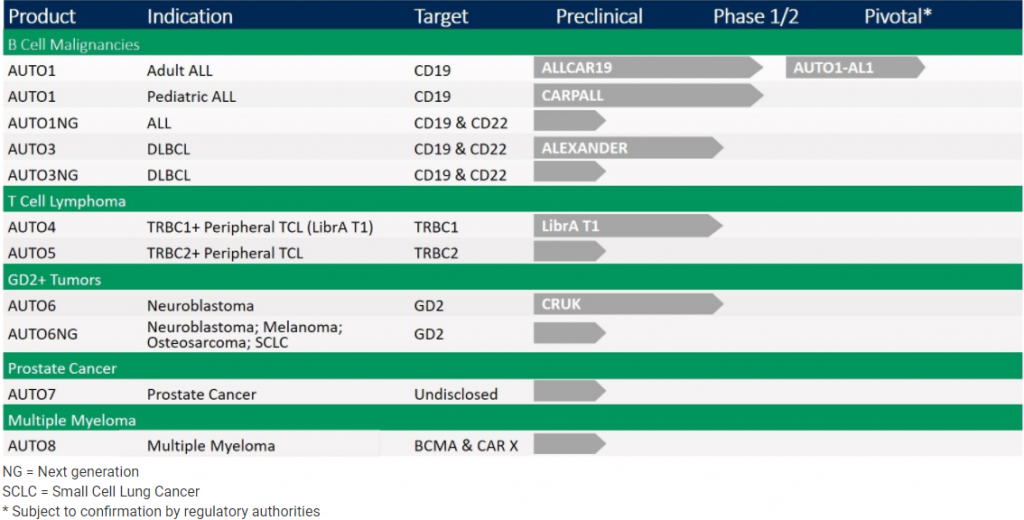
以“CAR-T细胞疗法的安全隐患”这一首要问题为切入点,Autolus希望以更安全的CAR-T疗法与这一领域的领头羊展开差异化竞争,以争夺市场。针对此,目前Autolus已开发了一系列候选产品, 除了靶向GD2的AUTO6外,还包括靶向CD19针对ALL的 AUTO1、双靶点CAR-T疗法 AUTO3、以TRBC1为靶点的AUTO4等,广泛覆盖血液学恶性肿瘤和实体肿瘤。
Autolus在研管线(资料来源:Autolus官网)
2020年4月,Autolus公司在美国站点启动AUTO1第一个关键研究AUTO1-AL1。
另外,AUTO2还携带了RQR8安全开关,允许用单次高剂量的利妥昔单抗(rituximab)消除T细胞。
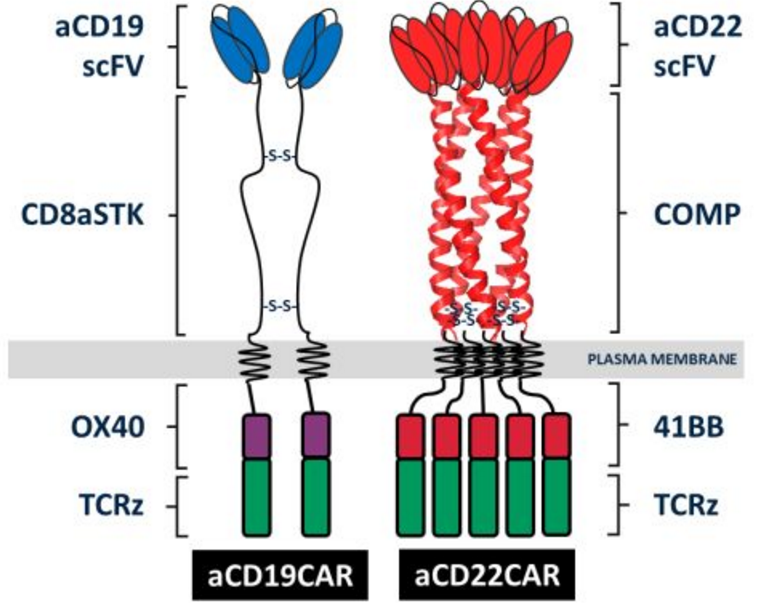
AUTO3的分子结构:同时靶向CD19和CD22
在2020年9月份的ESMO大会上,Autolus公布了AUTO3针对DLBCL的临床研究数据。结果显示,截止到2020年8月13日,在35例患者接受AUTO3输注的患者中,可评估的有30例,其中客观缓解率为68%,完全缓解率为54%;同时与获得批准的CD19 CAR-T相比,AUTO3具有更优的耐受性和安全性,在中位随访为6个月的所有剂量队列中,达到完全缓解的患者中有93%未复发。
以TRBC1为靶点的针对外周T细胞淋巴瘤的程序性T细胞治疗。AUTO4的设计目的是选择性地杀死癌性T细胞,这种方式可以保留一部分患者正常、健康的T细胞以维持免疫力。由于AUTO4选择了一种针对T细胞的新机制,Autolus还为其编程了一个“安全开关”,以便在患者在治疗过程中出现严重的副作用时,通过消除编程的T细胞来控制毒性。
目前,AUTO4正在进行TRBC1阳性外周T细胞淋巴瘤I期临床试验。
总得来说,从血液瘤到实体瘤,从疗效性到安全性,Autolus公司的CAR-T疗法目前体现出了一定过硬的实力,而以安全性为突破点,也的确为其提供了一种差异化竞争的策略。
不过就实体瘤这块来说,CAR-T治疗依旧还有很远的路要走,不仅仅是Autolus一家。


文章评论(0)