国内FGFR抑制剂领域迎来多项进展。
7月9日,信达生物宣布NMPA已受理其FGFR 1/2/3抑制剂pemigatinib片的上市申请,申报的适应症为:既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者。该药由Incyte研发,2020年被FDA批准治疗晚期胆管癌,2018年信达生物将其引进国内。
同日,据CDE官网,和黄医药FGFR 1/2/3抑制剂HMPL-453酒石酸盐片临床试验申请也获受理。
FGFR,即成纤维细胞生长因子受体,是受体酪氨酸激酶的亚族之一,包括FGFR1、FGFR2、FGFR3、FGFR4四种亚型,其配体包括FGF1、4、7、8、9、19等12种亚型。FGFR介导的信号传导通路包括RAS-RAF-MAPK、PI3K-AKT、信号转导子和转录激活子(STAT)以及磷脂酶Cγ(PLCγ)等,这些通路是正常细胞生长分化所必需的,参与新血管生成、细胞增殖和迁移、调节器官发育、伤口愈合等生理过程。
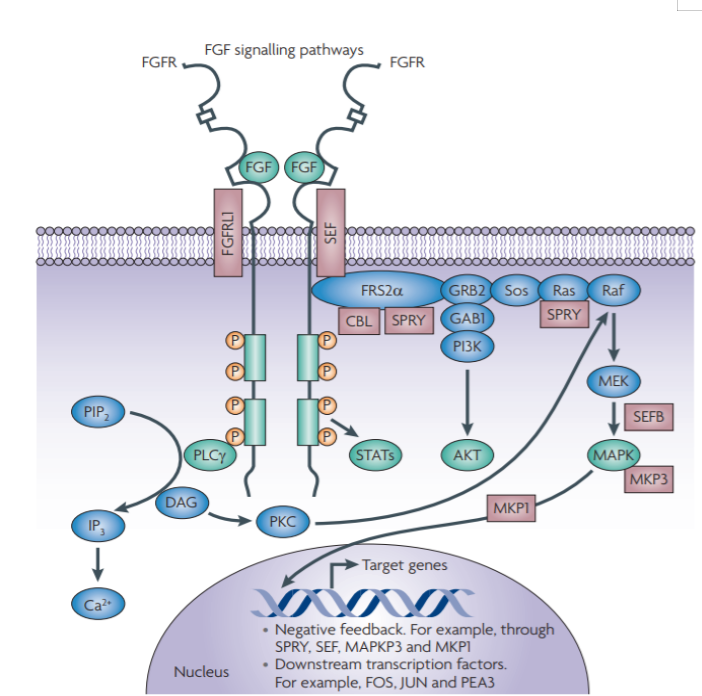
FGFR发生突变或者过表达时,FGFR信号通路过度激活,诱发正常细胞癌变。其中RAS-RAF-MAPK的过度激活可刺激细胞增殖与分化,PI3K-AKT过度激活会使得细胞凋亡受抑制,SATA与促进肿瘤侵袭和转移、增强肿瘤免疫逃逸能力相关,PLCγ信号通路是肿瘤细胞转移调控的重要途径。研究发现,FGFR基因异常在多种癌症中的普遍存在,其中尿路上皮癌、乳腺癌、子宫内膜癌、鳞状上皮癌等肿瘤高发。
FGFR是目前“不限癌种”疗法聚焦的热门靶点之一,目前已经有三款针对该靶点的药物获批,即强生的Balversa(erdafitinib)、Incyte公司Pemazyre(pemigatinib)和BridgeBio/Helsinn的Truseltiq(infigratinib)。
erdafitinib是Astex公司发现的一种口服FGFR激酶抑制剂,2008年强生与Astex公司就该药达成独家全球授权和合作协议,2019年4月被FDA批准用于携带特定FGFR基因改变的局部晚期或转移性尿路上皮癌(mUC)成人患者,具体为:携带易感FGFR3或FGFR2基因改变、并且接受至少一种含铂化疗期间或之后(包括新辅助或辅助含铂化疗12个月内)病情进展的局部晚期或转移性UC成人患者。据悉,Balversa的定价为10,080美元-22,680美元/疗程,为期28天。Nature Review Drug Discovery预计到2024年该药的销售额约为12亿美元。
pemigatinib是Incyte公司发现和研发的一款针对FGFR 亚型1、2、3的强效选择性口服抑制剂,2020年4月被FDA批准用于治疗先前已接受过治疗、存在FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌(CCA)患者,2018年12月,信达生物与Incyte公司达成战略合作和独家授权许可协议,获得包括pemigatinib在内的3款药物单药或联合治疗在中国内地及香港、澳门和台湾地区的临床开发与商业化授权。据悉,Pemazyre的上市价格为每疗程1.7万美元。平均治疗时间约为6个月,8或9个疗程,每位患者的成本约为13.6万至15.3万美元,2020年其销售额为2590万美元。
infigratinib是一种创新型、口服、FGFR亚型1、2、3选择性强效抑制剂,2021年5月被FDA批准用于治疗先前接受过治疗、携带FGFR2融合或重排的局部晚期或转移性CCA患者。该药是BridgeBio于2018年初从诺华Novartis引进,BridgeBio和Helsinn共同负责该药在美国市场的商业化,Helsinn负责该药在美国以外(不包括大中华区)地区的独家商业化,联拓生物负责该药在大中华区(中国大陆、香港、澳门)的临床开发、注册申请和未来的商业运营中国市场的开发和商业化。据悉,BridgeBio计划在两周内推出Truseltiq,价格为每月2.15万美元,每6个月的价格约为12.9万美元。
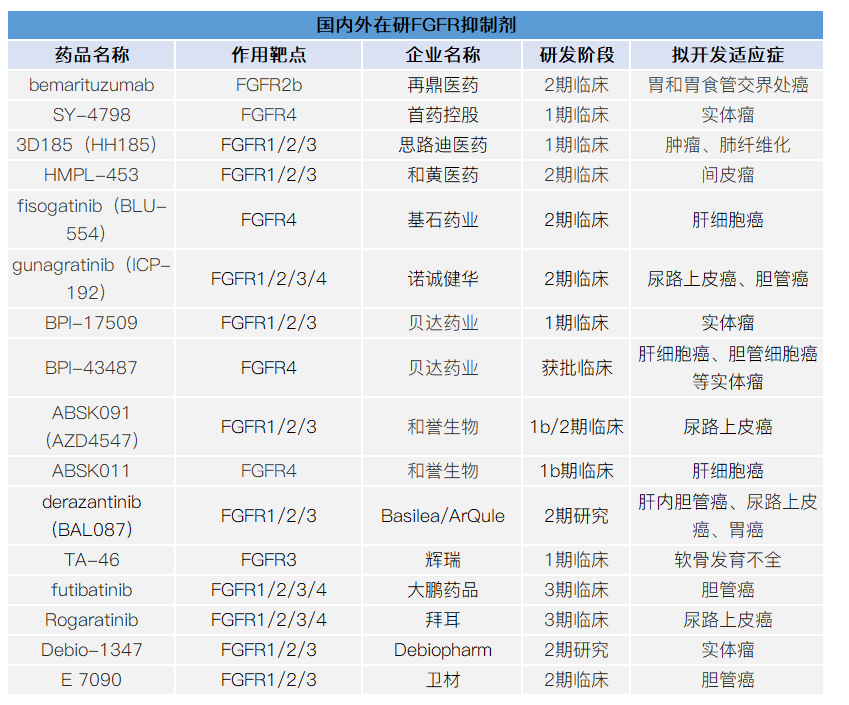
FGFR抑制剂的发展为FGFRs驱动的肿瘤患者带来了靶向治疗的希望,除了上述3款,目前国内外多家企业布局FGFR抑制剂市场,详见下表。值得一提的是,FGFR抑制剂类型已从小分子扩大至大分子,适应症也从胆管癌、尿路上皮癌扩大至肝纤维化、软骨发育不全等。
bemarituzumab是一款针对FGFR2b的单克隆抗体,具有双重作用机制,不但可以通过与FGFR2b结合,阻断其介导的生长因子的信号传导,而且可以通过抗体依赖性细胞介导的细胞毒作用(ADCC)杀伤癌细胞。2期临床研究结果显示:bemarituzumab与化疗联用,在至少10%肿瘤细胞过度表达FGFR2b的患者亚群中,显著改善患者的无进展生存期和总生存期。2021年4月,该药被FDA授予突破性疗法认定,联合化疗一线治疗HER2阴性局部晚期或转移性胃癌和胃食管结合部癌患者。
SY-4798是首药控股自主研发的具有完全知识产权和全新化合物结构的新一代选择性FGFR4小分子抑制剂。
3D185是FGFR 1/2/3靶向的小分子抑制剂,临床前研究表明:3D185具有抗肿瘤活性强,PD-PK特征优良,毒性低和生物利用度高等优点,且有CSF1-R靶向作用,适合在肿瘤免疫治疗领域与PD-1/PD-L1联合用药。2018年8月,思路迪医药与海和生物就该药达成战略合作,获得在全球范围内研发、生产和商业化该药的授权许可,用于治疗肿瘤和肺纤维化。
HMPL-453是一种潜在同类最佳高选择性高效小分子抑制剂,对FGFR1/2/3的抑制作用IC50处于低纳摩尔水平,在筛选了292个激酶后显示了良好的选择性。HMPL-453在FGFR异常活化的肿瘤模型中展现出的强效抗肿瘤活性。
fisogatinib是一种可口服的,强效高选择性FGFR4抑制剂,目前处于II期临床,适应症为肝细胞癌。该药由Blueprint Medicines开发,2018年基石药业获得该药以及Avapritinib和BLU-667在大中华区的权益。
gunagratinib诺诚建华自主研发的第二代泛FGFR抑制剂,对于FGFR家族的4种激酶均有很强的抑制效果,尤其在肝内胆管癌等实体瘤的治疗中具有良好的潜力,今年6月被FDA授予治疗胆管癌的孤儿药资格。
BPI-17509是一种具有全新化学结构的强效、高选择性FGFR1/2/3小分子口服抑制剂,拟用于实体瘤等FGFR基因变异的各类肿瘤治疗,目前针对实体瘤的临床试验正在顺利推进。而BPI-43487是一种强效、高选择性的FGFR4共价非可逆抑制剂,拟用于FGF19扩增的肝细胞癌、胆管细胞癌等实体瘤的治疗,目前该药已在国内获批临床。
ABSK091(AZD4547)是阿斯利康研发的一款小分子FGFR亚型1、2及3高效、选择性抑制剂,2019年11月和誉医药从阿斯利康获得该药的全球开发、生产和商业化权益。2020年12月,该药治疗伴有FGFR2或FGFR3变异的尿路上皮癌患者方面的1b/2期临床试验申请获NMPA批准。而ABSK011是和誉医药独立开发、并拥有全球知识产权的创新FGFR4小分子口服抑制剂,目前已在内地启动治疗FGF19过表达晚期肝细胞癌的1b期临床试验。
derazantinib是ArQule公司研制的一款强效、口服FGFR激酶家族小分子抑制剂,对FGFR1、2、3具有很强的活性,而且该药还能抑制CSF1R(即集落刺激因子1受体激酶,其介导的信号对维持促肿瘤巨噬细胞很重要,已被确定为抗癌药物的潜在靶点)。2018年2月,Roivant Sciences与ArQule达成合作,获得在大中华区开发和商业化该药物的授权。2018年4月,Basilea Pharmaceutica与ArQule签订授权许可协议。目前,该药已在美国和欧盟被授予治疗肝内胆管癌的孤儿药资格,其治疗胆管癌FIDES-01研队列1已取得顶线结果。
TA-46是一种可溶性重组人FGFR3诱饵蛋白,通过与FGF结合,防止FGF与发生突变的FGFR3结合,从而抑制过度激活的FGFR3信号通路,使该通路正常化。目前,TA-46已完成I期临床试验,正开发作为每周一次的皮下注射给药,用于治疗儿童和青少年软骨发育不全。在美国和欧盟,该药均被授予了孤儿药资格。该药由Therachon公司开发,2019年辉瑞通过收购Therachon公司获得该药。
futibatinib(TAS-120)是一款口服、选择性、不可逆FGFR1-4小分子抑制剂,通过与FGFR1-4的ATP结合“口袋”不可逆地共价结合,抑制FGFR介导的信号传导,从而降低携带FGFR1-4基因变异的肿瘤细胞的增殖。2021年4月,该药被FDA授予治疗携带FGFR2基因重排或融合、经治局部晚期或转移性胆管癌患者的突破性药物资格。其治疗胆管癌的2研究FOENIX-CCA2的中期数据分析显示,在67名随访时间超过6个月,携带FGFR2基因融合或重排的肝内胆管癌患者中,futibatinib达到37.3%的客观缓解率,82.1%的疾病控制率,中位缓解持续时间达到8.3个月,中位无进展生存期达到7.2个月。
E7090是卫材研发的一款小分子FGFR1/2/3抑制剂,目前正在日本和国内进行2期临床。今年2月,该药被FDA授予治疗具有FGFR2融合基因的不可切除的胆道癌的孤儿药资格。
FGFR是目前靶向药物研发的一个热门靶点,竞争相对比较激烈,目前国内外多家企业布局,相信随着企业的不断努力,未来会有更多的FGFR靶向药物获批问世。
本文作者:亦
声明:本文为作者独立观点,不代表贝壳社公众号立场,仅做分享交流。如需转载,请留言。



文章评论(0)