再谈双抗江湖:风云再起,赛道进入高速冲刺阶段
不过目前,发令枪才刚刚打响,有资格参赛的选手寥寥无几。

来源:康方生物公告
在注册性II期临床研究数据分析显示,Cadonilimab治疗经含铂化疗失败的复发或转移性宫颈癌患者的疗效显著,且安全性良好。在目标适应症人群中,Cadonilimab与已上市PD-1单抗的公开数据相比,显示了更优疗效的潜力。
Cadonilimab是首创人源四聚体双抗,该药物是基于康方生物专有的TETRABODY技术研发而成,是全球首个进入临床试验的PD-1/CTLA-4双抗。Cadonilimab同时靶向两个经过验证的免疫检查点分子:程序性细胞死亡蛋白1(PD-1)及细胞毒性T淋巴细胞相关蛋白4(CTLA-4)。
最新临床数据将在相关的医学国际会议或医学期刊上发表。
此前,Cadonilimab于2020年7月获得FDA授予快速审批通道资格,并于2021年2月获得FDA授予治疗宫颈癌的孤儿药资格;2020年1 0月,Cadonilimab获得国家药监局审核同意纳入突破性治疗药物品种。目前,Cadonilimab联合化疗一线治疗晚期宫颈癌的III期临床研究已于2021年7月启动,治疗胃癌、肝癌、食道癌的临床试验也在稳步推进中。
康方生物在今年8月初刚刚获批国产第5款PD-1,而后又以超低售价将PD-1的价格战引向了白热化,引起了市场的强烈关注。康方生物之所以敢将PD-1两年的封顶治疗费用定价为3.9万元,一个原因是其借力于正大天晴庞大的销售网络企图以低价迅速占领市场,而最重要原因是康方生物的杀手锏不是PD-1,而是双抗。
Cadonilimab一旦获批,将作为首个国产双抗在未来占尽首发优势。不过,追赶者的脚步也从未停滞,这样的优势恐怕维持不了太久,就如同PD-1的局势发展一样。而康宁杰瑞是其国内市场上最强劲的竞争对手。

全球范围内上并无获批准的抗HER2双抗,唯一获批准的双重阻断HER2信号疗法是罗氏的赫赛汀(曲妥珠单抗)联合帕罗嘉(帕妥珠单抗)及化疗。尽管这种联合疗法对HER2高表达癌症呈现出疗效,但其可治疗的癌症适应症有限且对HER2低表达及HER2中表达癌症无效。
目前,KN026正在中国进行数项I/II期临床试验,并正在美国进行一项I期临床试验。KN026已在晚期HER2+乳腺癌及胃癌或胃食管结合部癌患者中表现出良好的初步疗效。国内有两款同靶点双抗进入临床,分别为百济/Zymeworks合作的Zanidatamab(ZW-25),以及天广实的MBS301,前者处于II期临床,后者处于I期临床。
然而这还不是康宁杰瑞唯一的核心双抗产品,其还有一款与康方生物针锋相对的PD-L1/CTLA-4双抗产品KN046。
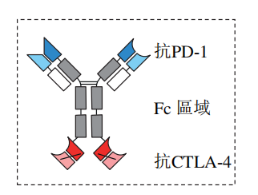
KN046可能成为全球首个同时针对两个经临床验证的免疫检查点PD-L1及CTLA-4的双抗。KN046的两种sdAb分别与PD-L1和CTLA-4结合,可靶向富集于PD-L1高表达的肿瘤微环境,有望达到双重阻断效果。
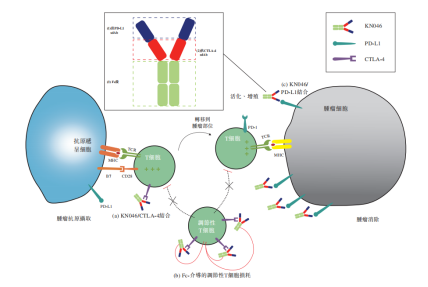
KN046的作用机制
来源:康宁杰瑞招股书
目前,KN046在国内启动了12项临床,其中包括一项II/III期临床和一项III期临床,均针对非小细胞肺癌,进度与康方生物的Cadonilimab差距不大。此外,KN046在澳大利亚、中国及美国已开展覆盖非小细胞肺癌、三阴乳腺癌、食管鳞癌、胸腺癌、肝癌、胰腺癌等10余种肿瘤的不同阶段临床试验。
因为康方生物在PD-1上的临床试验进度较康宁杰瑞的PD-L1要快,并且背靠正大天晴这棵大树,所以康方生物在二级市场上的市值比康宁杰瑞高出一倍。但是两者的差距正在逐步缩小,据预测,康宁杰瑞的PD-L1大概率会在年内获批,届时将成为首个获批的国产PD-L1。而此次将核心双抗License-out给石药集团,在商业化能力上面与康方生物的差距缩短了一大截,未来康宁杰瑞的估值有望与康方生物并驾齐驱。
其中罗氏的“舒友利乐”和百济神州代理安进的“倍利妥”已分别于2018年12月和2020年12月获国家药监局批准上市,登陆我国市场。今年8月19日,“倍利妥”在中国境内开出了第一张药方,正式商业化上市销售。
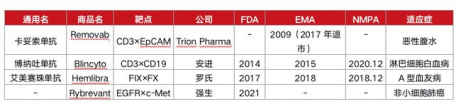
全球范围内双抗产品已获批情况,来源:https://www.163.com/dy/article/GC5BFG7805384OHU.html
当前国内双抗的竞争格局像极了当初的PD-1,跨国制药巨头先行,大量国产紧随其后。
据统计,目前国产双抗处于临床阶段的项目达到了67个,其中有35款产品的靶点之一都是PD-1/L1,其次是双抗经典靶点CD3,共有15个项目。全球范围内的PD-1/L1相关双抗共77款,国内项目又占到了近半数。在可以预见的未来,双抗江湖又是一片血雨腥风。
事实上,重押双抗赛道的还不是康方生物和康宁杰瑞,信达生物是国内双抗布局最多的企业之一,目前已经有7款双抗进入临床,其中6款都涉及PD-(L)1。其中PD-1/PD-L1双抗IBI318进展最快,已于2020年11月启动了一项Ib/III期临床,评估IBI318联合紫杉醇用于经标准一线及以上化疗失败的小细胞肺癌患者。
百济神州背靠国际巨头安进,License-in大量双抗项目,目前拥有6款处于临床阶段或已上市的双抗产品,包括Blincyto(CD3×CD19)、AMG701(CD3×BCMA)、AMG160(CD3×PSMA)、AMG199(CD3×MUC17)、ZW25(HER2×HER2)、ZW49(HER2×HER2 ADC)。其中,前四款产品为百济神州与安进共同研发的双特异性T细胞结合抗体(BiTE)免疫疗法,ZW25、ZW49与Zymeworks共同研发。
自主研发方面,百利药业、友芝友、宜明昂科申报临床数量居前;License-in方面,再鼎医药5500万美元从Macrogenics引进4款双抗;贝达药业从Merus引进EGFR/cMET双抗等,先声药业、信达生物、药明生物、恒瑞医药等则是引进了各式各样的双抗开发技术。
谈到技术,国内真正拥有双抗底层技术的企业并不多。早期的双抗设计比较直接,两个半抗体组合为双抗。这一阶段,异源二聚体的组合成为双抗底层技术的核心。很快,基于串联Fab、scFv、纳米抗体等的同源二聚体技术大量出现,双抗的构建门槛快速下降。国内的双抗技术,原创的底层技术包括药明生物基于TCR的WuxiBody、基于电荷的齐鲁MabPair、康宁杰瑞CRIB、爱思迈Exmab、深圳先进院等,更多的双抗技术则基于同源二聚体,基于scFv融合、纳米抗体融合等。
2、《竞逐双抗赛道,康方率先起跑,信达、康宁杰瑞进入3期,国产已有67个项目!PD-1的最热搭档的是谁?》,Insight数据库,2021年8月24日
3、《中国双抗新药竞争格局》,医药笔记,2021年6月20日
4、《中国双抗技术全梳理》,医药笔记,2021年8月16日
5、《国内进度最快的生物药管线一览!31款创新药已进入3期临床,下一家报产的是谁?》,搜狐网,2021年8月12日
6、《一文读懂全球上市双抗药物及国内研发进展》,网易,2021年6月10日
7、《还在讨论PD-1?业界大佬都在开发双抗了》,医学中文网,2021年8月2日
声明:本文为作者独立观点,不代表贝壳社公众号立场,仅做分享交流。如需转载,请留言。


文章评论(0)