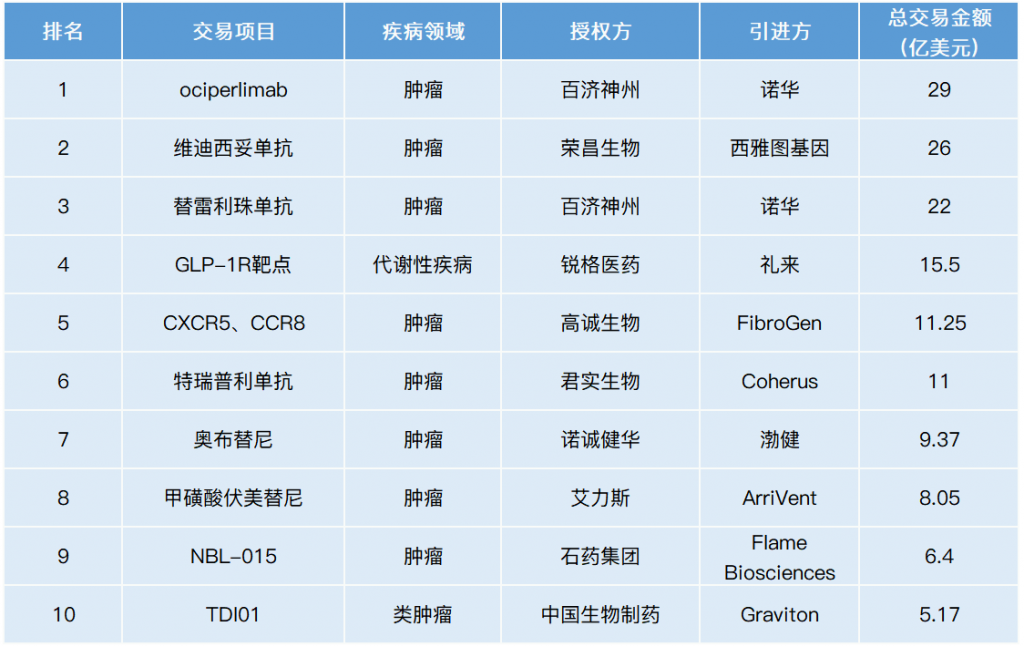
2021年1月至12月,据不完全统计,国内药企license out交易数量超30项,共披露的交易金额约133亿美元。现贝壳社依据总交易金额对全年license out前10名进行汇总,以供大家参考。
从疾病领域来看,2021年中国药企license out交易TOP10项目涵盖肿瘤、代谢性疾病领域,其中抗肿瘤新药占比高达90%。从交易总额来看,TOP10中有6项总交易额超10亿美元(2020年仅2项),其中,百济神州以29亿美元license out TIGIT抑制剂ociperlimab稳居榜首。研究表明,抑制TIGIT靶点可诱导有效的抗肿瘤免疫应答,且TIGIT与PD-1/PD-L1抑制剂联合使用具有增强抗肿瘤反应的潜力,有望克服PD-1抑制剂的耐药性难题。
以下为2021年度license out 交易TOP10详细内容:
12月20日,百济神州宣布扩大与诺华的合作,双方将在北美、欧洲和日本共同开发、生产和商业化百济神州在研TIGIT抑制剂ociperlimab。根据协议,百济神州可获得3亿美元的现金预付款,6亿或7亿美元的选择权款项。此外,诺华行使选择权后,百济神州有权获得至多7.45 亿美元的药政获批里程碑款项、11.5亿美元的销售里程碑款项,以及一定的特许权使用费。
据悉,ociperlimab是一款由百济神州自主开发的人源化IgG单克隆抗体,具有完整的Fc功能。研究表明,抑制TIGIT靶点可诱导有效的抗肿瘤免疫应答,且TIGIT通路与PD-1协作,可最大程度抑制效应肿瘤浸润免疫细胞,并增强对抗PD-1疗法的抵抗力。
8月8日,荣昌生物宣布与西雅图基因(Seagen Inc.)达成合作,授予西雅图基因维迪西妥单抗在亚洲区(除日本、新加坡外)以外的全球开发和商业化权益。根据协议,荣昌生物可获得2亿美元首付款和最高可达24亿美元的里程碑款项。此外,荣昌生物将获得维迪西妥单抗净销售额从高个位数到百分之十几的梯度销售提成。
据悉,维迪西妥单抗是一款靶向HER2的新型ADC新药,具有对HER2的高亲和力和细胞内吞效率。2021年6月,该药已获NMPA有条件批准上市,成为首个用于治疗局部晚期转移性胃癌的国产ADC新药;近日,注射用维迪西妥单抗的新适应症再次获得NMPA批准上市,用于治疗既往接受过含铂化疗且HER2过表达即免疫组化检查结果为2+或3+的局部晚期或转移性尿路上皮癌患者。
1月12日,百济神州宣布与诺华达成合作,授予诺华替雷利珠单抗在多个国家的开发、生产与商业化权益。根据协议,百济神州可获得6.5亿美元的首付款,至多13亿美元的注册里程碑款项、2.5亿美元销售里程碑款项,另有资格获得替雷利珠单抗在授权地区未来销售的特许权使用费。
据悉,替雷利珠单抗是一款人源化lgG4抗程序性死亡受体1(PD-1)单克隆抗体,可最大限度地减少与巨噬细胞中的 FcγR 受体结合。目前,替雷利珠单抗已获NMPA批准用于复发或难治性经典型霍奇金淋巴瘤、局部晚期或转移性尿路上皮癌、局部晚期或转移性非鳞状非小细胞肺癌、肝细胞癌、局部晚期或转移性鳞状非小细胞肺癌、局部晚期或转移性非小细胞肺癌二三线的治疗,且前5项适应症均被纳入国家医保目录。
12月10日,锐格医药宣布与礼来达成合作,授予礼来GLP-1R靶点专利许可。此后,双方将在临床前药物开发、临床研究及商业化方面合作,开发针对代谢性疾病领域的创新疗法。根据协议,锐格医药可获得总计5000万美元的预付款,其中包括部分股权投资。此外,锐格医药还将获得最高15亿美元的潜在临床前、临床开发和商业化里程碑款项,以及个位数至较低两位数的全球销售分成。
据悉,GLP-1R是II型糖尿病最为有效的治疗靶点之一,诺和诺德产品司美格鲁肽注射液已在全球52个国家上市,2020年全球销售额较2019年增长88.8%,达到212.11亿丹麦克朗(34.5亿美元)。预计到2029年,GLP-1R全球市场规模可以超过300亿美元。
6月17日,高诚生物宣布与FibroGen达成合作,FibroGen获得高诚生物Galectin-9项目独家授权许可,及CXCR5、CCR8项目独家开发、生产和商业化授权选择权。根据协议,高诚生物可获得2,500万美元首付款,及最高可达11亿美元的里程碑付款。此外,高诚生物还可获得基于产品全球净销售额的特许权使用费。
据悉,Galectin-9可抑制针对髓系恶性肿瘤和实体瘤的抗肿瘤免疫,有关Galectin-9项目的先导候选抗体预计将于2023年第一季度进入临床开发阶段。CXCR5和CCR8项目可用于肿瘤及自身免疫疾病,有关CXCR5和CCR8项目的先导候选抗体预计将于2023年中期进入临床开发阶段。
2月1日,君实生物宣布与Coherus BioSciences(Coherus)达成合作,授予Coherus特瑞普利单抗注射液在美国和加拿大的开发、商业化权益。此外还包含JS006和JS018-1在这些区域的选择权。根据协议,君实生物可获得1.5亿美元的首付款,不超过3.8亿美元的里程碑款项及特瑞普利单抗年销售净额20%的销售分成。对于JS006和JS018-1项目,君实生物可收到每个项目3500万美元的执行费。
据悉,特瑞普利单抗注射液是我国首个批准上市的PD-1单抗药物,可用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗以及既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌(NPC)患者的治疗,目前已被纳入国家医保目录。
此外,FDA还授予特瑞普利单抗黏膜黑色素瘤快速通道资格认定,以及黏膜黑色素瘤、鼻咽癌、软组织肉瘤3项孤儿药资格认定。
7月12日,诺诚健华宣布与渤健达成合作,授予渤健奥布替尼在多发性硬化领域的全球独家权益,以及除中国(包括香港、澳门和台湾)以外区域内的某些自身免疫性疾病领域的独家权益。根据协议,诺诚健华可获得1.25亿美元首付款,并有资格获得高达8.125亿美元的潜在临床开发里程碑、商业里程碑款项。
据悉,奥布替尼是一款具有高选择性和血脑屏障渗透能力的BTKi,可在中枢神经系统实现高靶点占有率。此外,奥布替尼还具有抑制中枢神经系统中的B细胞和髓样细胞的功能潜力,有望为所有多发性硬化亚型的疾病进展提供有益的临床价值。
截至目前,奥布替尼已获得NMPA批准上市,用于治疗复发/难治慢性淋巴细胞白血病(R/R CLL)/小淋巴细胞淋巴瘤(R/R SLL)、复发/难治套细胞淋巴瘤(R/R MCL),且正在国内开展一项针对复发缓解型多发性硬化患者(RRMS)的全球2期临床研究。
7月1日,艾力斯宣布与ArriVent Biopharma(ArriVent)达成合作,授予ArriVent甲磺酸伏美替尼在海外(全球除中国大陆及港澳台地区)的独家开发及商业化权益。根据协议,艾力斯可获得4,000万美元的首付款,累计不超过7.65亿美元的研发和销售里程碑款项(达到约定的研发或销售里程碑事件),销售提成,以及ArriVent一定比例的股份。
据悉,甲磺酸伏美替尼是艾力斯自研的首款商业化产品,已获NMPA附条件批准上市,用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞性肺癌成人患者。
8月17日,石药集团宣布与Flame Biosciences达成合作,授予Flame Biosciences NBL-015在大中华(包括中国大陆、香港、澳门及台湾)以外地区开发、制造及商业化权益。根据协议,石药集团可获得750万美元的首付款,最多1.725亿美元的开发里程碑款项,及最多4.6亿美元的销售里程碑款项。此外,还有权获得按许可产品若干百分比的销售分成。
据悉,NBL-015是一种全人源抗Claudin 18.2单克隆抗体,并经过蛋白工程优化,具有增强的ADCC、CDC和ADCP效应。临床前研究显示,NBL-015具有免疫原性低、安全性高、亲和力强及抗肿瘤活性高的潜在优势,有望成为治疗胰腺癌和胃癌的“best-in-class”靶向药物。目前,NBL-015已处于临床开发阶段,并已获FDA授予的治疗胰腺癌和胃癌(包括食道胃结合部癌)孤儿药资格认定。
2月24日,中国生物制药宣布与Graviton Bioscience Corporation(Graviton)达成合作,授予Graviton TDI01在大中华以外地区共同开发及商业化权益。根据协议,中国生物制药可获得产品年度销售收入一定比例的许可费、销售提成等收益,最高可达5.175亿美元。
据悉,TDI01是一种全新、高选择性的Rho/Rho相关卷曲螺旋形成蛋白激酶2(ROCK2)抑制剂,可通过高选择性地抑制ROCK2信号通路,发挥抑制纤维化进展、抗炎和免疫调节等多重作用,在肺纤维化、肝纤维化等领域具有较好的治疗潜力。
2020年,TDI01已先后在FDA及CDE批准下开展临床试验,拟开发用于治疗特发性肺纤维化(IPF)。其中,IPF是一种慢性、进行性、纤维化性间质性肺疾病,多发于中老年人群,诊断后的平均生存期仅为2.8年,被认为是一种比癌症更凶险的“类肿瘤疾病”。
整体来看,交易频频的license out已足以证明我国药企的研发能力得到了国际市场的认可。至此,license out也无疑成为中国创新药企业成功出海、走向国际化的敲门砖,肿瘤创新药则成为出海利器。


文章评论(0)