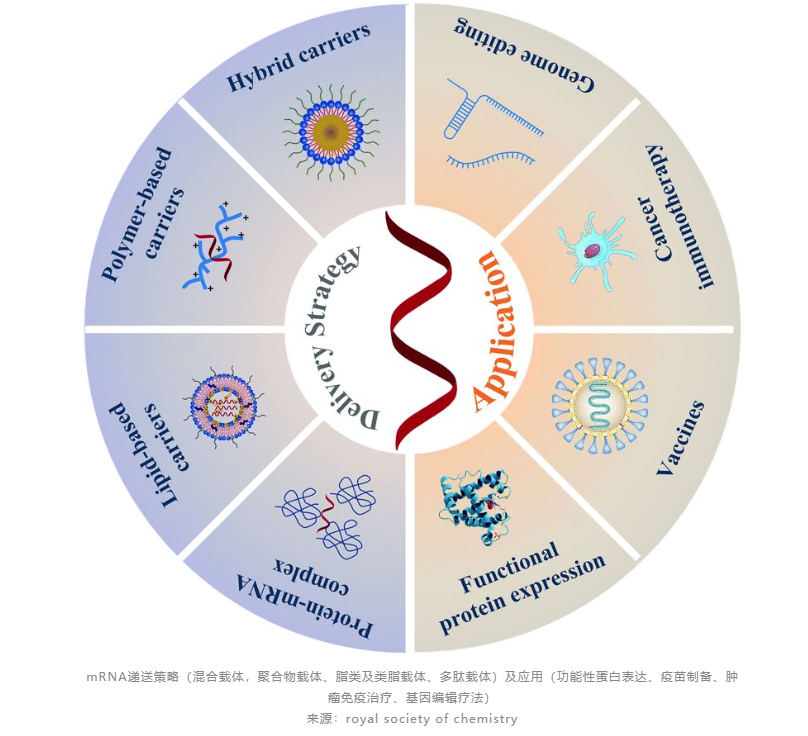
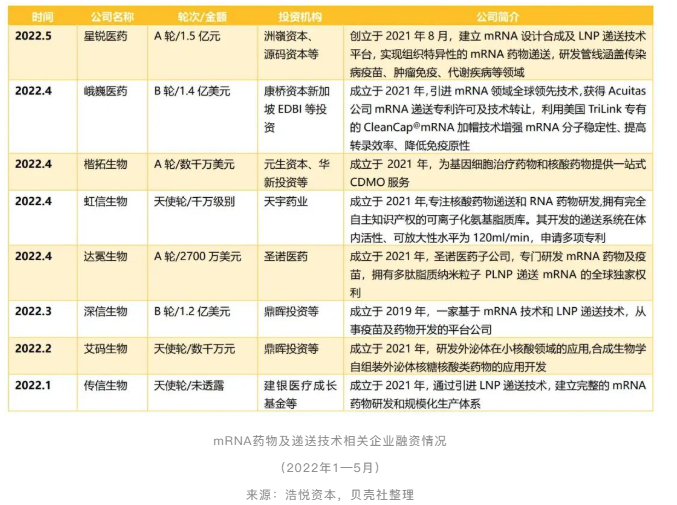
mRNA递送技术持续升温,数十亿资金密集砸向初创企业
mRNA疫苗的制备大体分为三个阶段:第一是基因编辑获得特定DNA序列的质粒;第二阶段是质粒转录成mRNA;第三阶段是核酸药物的关键难点,将纯化后的mRNA进行包装,防止降解,再递送到患者病灶处。在目前主流的技术路径下,各阶段成本占比约为12%、77%和11%。虽然mRNA递送成本不算高,但技术含金量很高。
递送载体可谓“身担重任”,必须帮助mRNA克服细胞内外多重屏障进入细胞质,避免与外部环境接触,并使mRNA从内涵体或溶酶体中成功逃逸不被降解。要完成使命,递送载体本身在设计上还得靠表面修饰,降低载体与血浆蛋白的非特异性结合,降低被巨噬细胞的清除,增强与靶细胞的相互作用,并使mRNA跨越细胞膜屏障,最终起到表达目标蛋白、激活机体免疫应答的目的。
为了提高递送效率并尽可能降低治疗副作用,研究者开发了多种包裹mRNA的递送载体,利用天然或合成材料(如脂类、聚合物、多肽、抗体、小分子或金属等)制成具有不同几何结构(纳米颗粒、微粒、共轭物、固体器件或水凝胶等)的纳米颗粒,将mRNA安全输送到靶细胞表达正常蛋白。
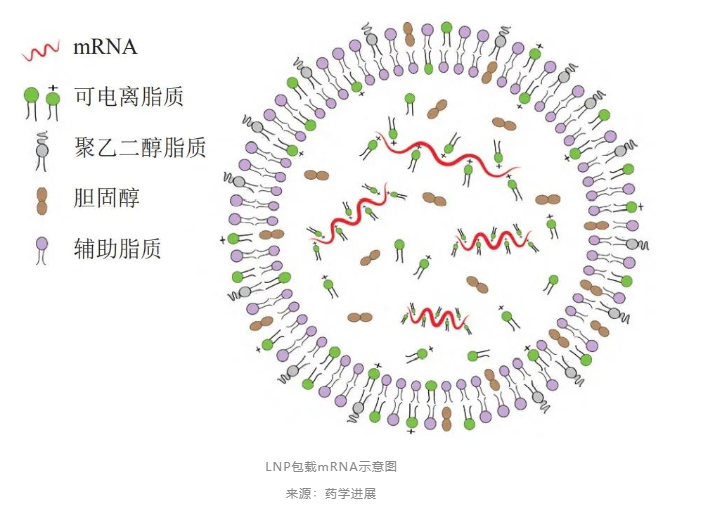
早在2018年,FDA批准的首款siRNA药物Onpattro(Alnylam)就使用了LNP。LNP是较早获得市场和监管认可的成熟递送载体,包括mRNA疫苗在内的临床试验数量也达十几例。但应用LNP技术的弊端是专利所属权问题,其底层专利掌握在Alnylam手中,为此Alnylam还起诉了Pfizer和Moderna两家公司。
LNP载体通常包含4种组分,分别为阳离子或可离子化的脂质、聚乙二醇PEG修饰的脂质、中性脂质和胆固醇。不同脂质成分发挥不同的作用,阳离子脂质头部带有正电荷,可与带负电的mRNA形成复合物,但正电荷纳米粒子也具有一定的细胞毒性,且易被单核吞噬细胞清除。
而可离子化氨基脂质分子在正常酸碱度值时呈中性,在酸碱度值降低时会发生质子化而带有正电荷,从而一定程度上避免阳离子脂质细胞毒性的缺点。其他磷脂、胆固醇、聚乙二醇化脂质等脂质成分,可影响LNP的稳定性、递送效率。此外,LNP表面也可以连接特异性抗体分子等,赋予LNP-mRNA递送系统组织或细胞的靶向性,起到精准治疗的目的。
聚乙烯亚胺(PEI)是早期常用于运载mRNA的聚合物,转染率虽高但生物毒性也较大,之后还发展出利用聚酰胺胺(PAMAM)、聚丙烯亚胺(PPI)等树枝状大分子。但聚合物递送的通病是生物相容性欠佳,均具有细胞毒性且难降解。为提高安全性、有效性和稳定性,一些研究还采用聚乳酸(PLA)、聚β-氨基酯(PBAE)、聚乳酸-羟基乙酸(PLGA)等聚酯、壳聚糖和葡聚糖等天然聚合物衍生物,能更好地满足生物降解要求。
以斯微生物为例,其开发的LPP纳米递送平台是一种以聚合物包载mRNA为内核、磷脂包裹为外壳的双层结构。LPP的双层纳米粒比LNP有更好的包载、保护mRNA效果,并能随聚合物的降解逐步释放mRNA分子,再通过抗原递呈激活T细胞免疫反应,达到免疫治疗效果。斯微生物处于I期临床的SARS-CoV-2疫苗SW-0123,就是采用LPP技术。
(2)制备纳米脂质体;
(3)将纳米脂质体与PPs溶液混合,或者在脂质膜水化步骤时加入PPs溶液自组装形成LPP。
CPPs发现于1988年,是一种短序列肽,能帮细胞摄取多种分子,虽然其跨膜机制仍不清楚,但人工已能成功合成CPP,凭借较低的电荷密度和优秀的穿越细胞膜能力,在药物递送、蛋白质、质粒DNA和siRNA等领域有巨大潜力,在mRNA递送领域大多处于研究探索阶段。
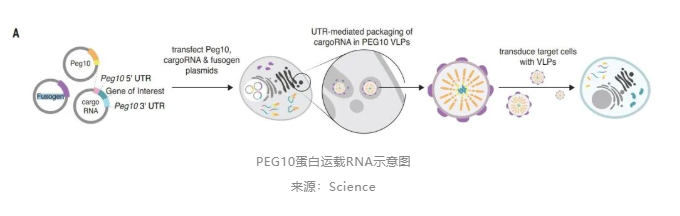
蛋白载体的另一颠覆性成果,是2021年8月由基因编辑先锋人物张锋及团队开发的SEND递送技术。SEND的核心是哺乳动物逆转录病毒样蛋白PEG10,具有在细胞之间运输RNA的潜力。
研究人员发现PEG10专门用来识别并包装mRNA的基因序列,将信号序列加在RNA分子两端时,PEG10就能装载“货物”RNA。再利用融合技术,为PEG10添加病毒融合蛋白Fusogen,让PEG10能与靶向特异的细胞表面融合,将载荷RNA递送到细胞质中。发布在Science上的该研究虽然仍处于小鼠实验阶段,大胆猜测距离临床实验不会相隔太久,因为该机制借用天然已存在的运载RNA的蛋白工具,其安全有效性早已经过大自然进化的检验。
除上述载体外,也有一些新型材料被用于mRNA疫苗递送研究,如无机纳米材料、水凝胶、病毒样颗粒等,大多处于临床前研究阶段。
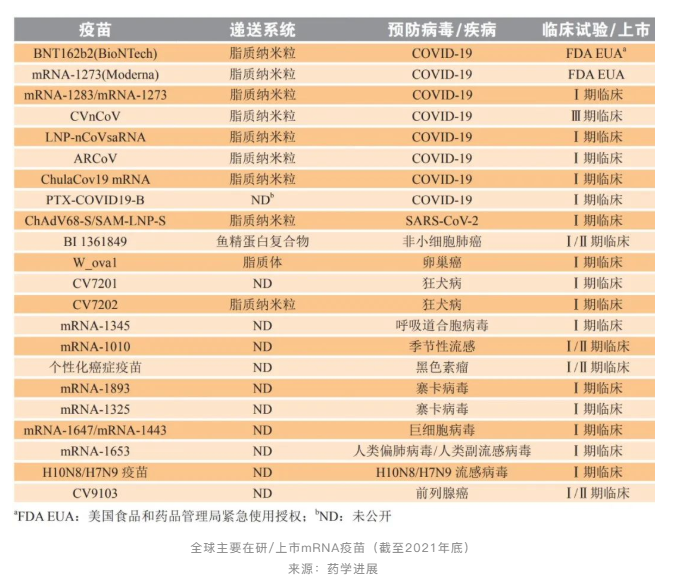
其次,进展较快的还有TranslateBio and Inc.、eTheRNA Immunotherapies、ethris GmbH、Argos Therapeutics、In-Cell-Art、Tiba Biotech、Arcturus Therapeutics、Arbutus Biopharma Corporation、Acuitas Therapeutics等,在mRNA合成和递送领域各有所长。国内圣诺医药、艾博生物、斯微生物、冠昊生物、沃森生物、复星医药、康希诺等企业也都是mRNA疫苗领域的佼佼者。
预计未来mRNA递送技术将继续朝安全稳定、包埋效率高、靶向性好、毒副作用小、便于储存的方向发展,不断升级优化,协助更多mRNA疫苗尽早上市。
1、苗佳颖、陆伟,应用于mRNA 疫苗的非病毒载体递送系统研究进展,药学进展,2022,46 (2): 84-92;
2、Segel et al,Blake Lash,Feng Zhang, Mammalian retrovirus-like protein PEG10 packages its own mRNA and can be pseudotyped for mRNA delivery,Science 373,882-889 (2021);
3、姚恒美,mRNA疫苗发展态势研究,2021年8月,第17卷,第4期.


文章评论(0)