肿瘤精准治疗时代:创新免疫疗法进入黄金发展阶段
作者:北北
此外,随着CAR-T、CAR-M等新型免疫治疗方法在血液肿瘤领域的出色表现,免疫治疗进入了一个发展的新阶段。
虽然近年来涌现出了多种肿瘤免疫治疗的新靶点和候选药物,但大多数仍处于非常早期的发展阶段。不幸的是,临床研究表明,这些候选药物中的相当一部分可能无法作为单一疗法发挥令人满意的效果。
因此,如何有效探寻不同肿瘤治疗手段的联合治疗方案,以及ICB(免疫检查点抑制剂)和CAR-T治疗的临床疗效相关的生物标记物,是当下肿瘤免疫及细胞疗法的关键所在。
然而,直接向患者注射细胞因子可能会导致严重的的毒副作用,这就需要发现能够介导抗肿瘤反应且能够精准定位肿瘤部位的特异性免疫细胞。
第一信号是抗原特异性信号,涉及T细胞表面受体(TCR)与抗原肽主要组织相容性复合体(MHC)的特异性结合。
第二信号由抗原呈递细胞(APC)表面的共刺激分子提供,为非特异性协同刺激信号。
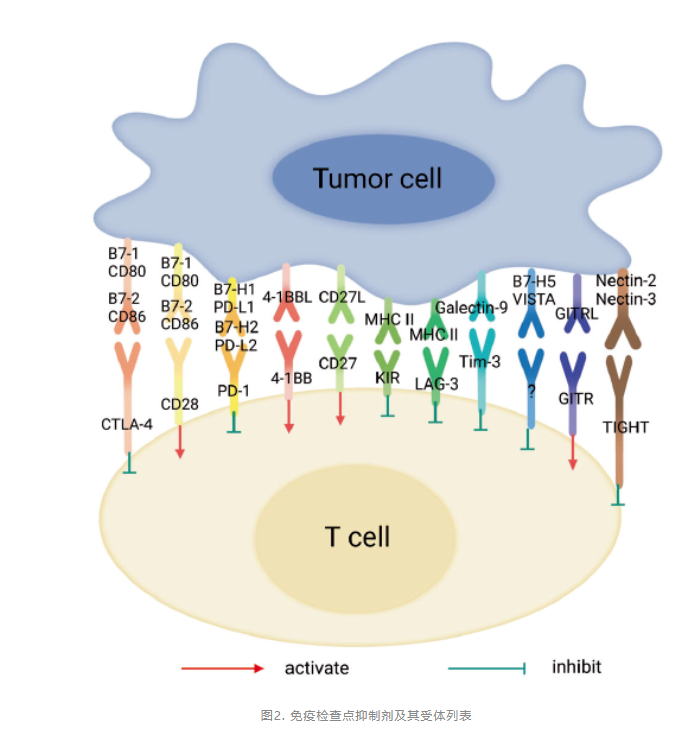
如何有效的促进T细胞的活化并对恶性肿瘤细胞进行清除,是肿瘤免疫治疗的核心。
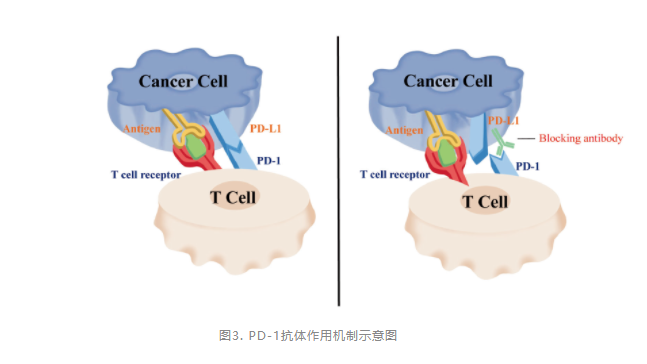
PD-1抑制剂可以与PD-1特异结合,从而减弱T淋巴细胞的免疫抑制调节和促使T淋巴细胞杀伤肿瘤细胞功能的发挥(图3)。临床前研究表明,PD-1抑制剂可以抑制肿瘤细胞增殖并诱导各种肿瘤细胞的程序性细胞死亡(凋亡)。PD-1抗体还可以增强由其他细胞毒性药物(如阿霉素)介导的肿瘤细胞凋亡。
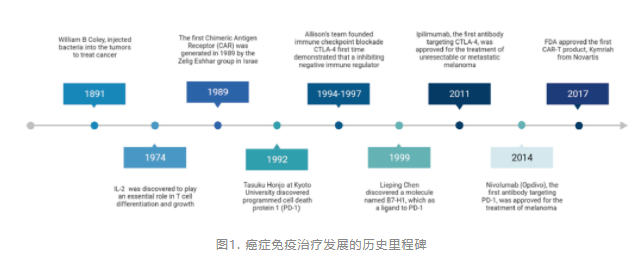
1996年,James Allison发现阻断CTLA-4导致小鼠肿瘤消退。在随后的人体研究中,伊匹木单抗(CTLA-4抗体)是第一个在临床研究中应用的CTLA-4抑制剂,成功抑制了难治性转移性黑色素瘤患者的疾病进展,这是癌症免疫治疗的里程碑。
有趣的是,CTLA-4在黑色素瘤、肺癌和肾癌浸润的Treg细胞表面高度表达。虽然后来研究发现,Treg清除不是伊匹木单抗临床抗肿瘤疗效的主要机制,但这些结果表明,在某些情况下,CTLA-4抗体也可能抑制TME中的Treg细胞,并有助于免疫激活。
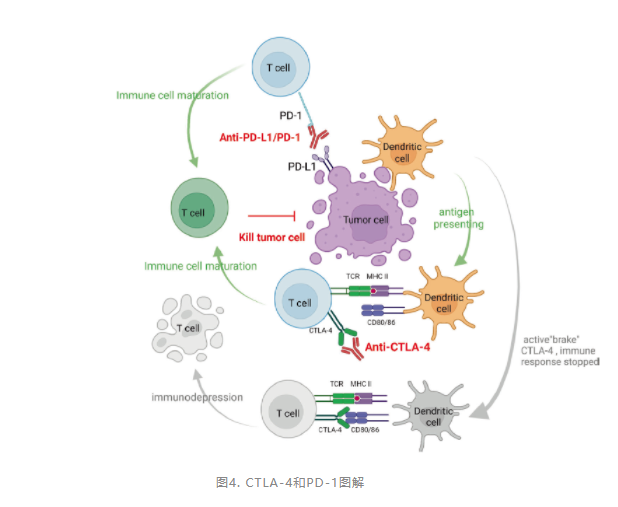
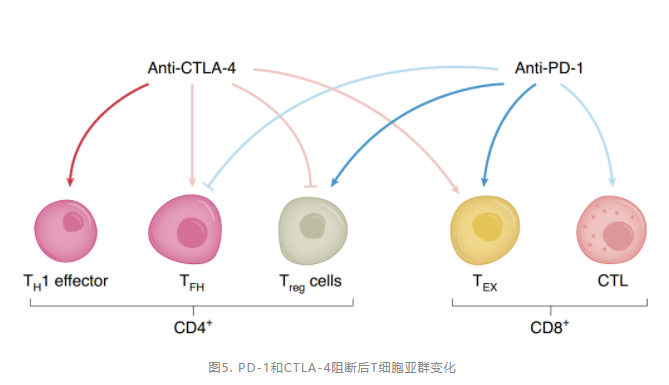
CTLA-4和PD-1 ICB的联合治疗(纳武利尤单抗联合伊匹木单抗)确实产生了良好的临床反应,但比单一治疗产生了更显著的不良反应,期待更为有效的协同抗肿瘤方案的出现。
随着免疫检查点CTLA-4、PD-1,及其配体PD-L1的相继发现,相关抗体药物的研发也进入到快车道。相继推动伊匹木单抗、纳武利尤单抗、帕博利珠单抗、度伐利尤单抗等免疫检查点抑制剂问世,将肿瘤治疗由化疗、靶向治疗时代引进到免疫治疗时代,开启了肿瘤免疫治疗的新篇章。
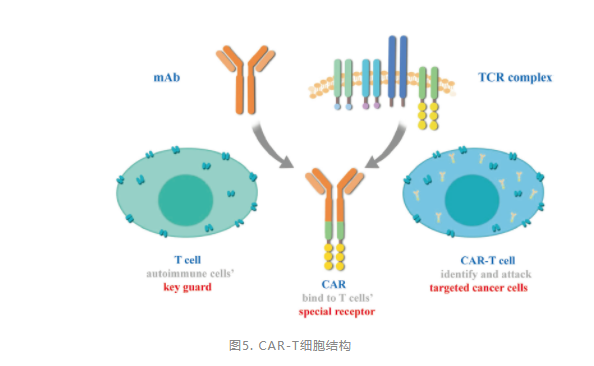
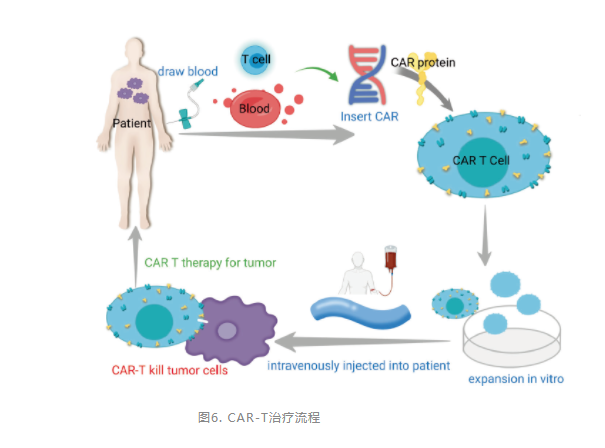
完整的CAR-T结构包括抗原结合区、跨膜链接区和胞内信号区三个部分。从而使得T细胞实现了抗原特异性的、非MHC限制的活化及其效应的增强。
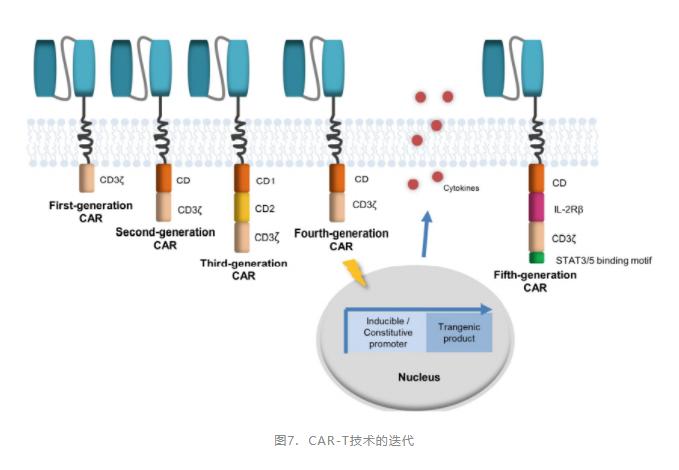
目前,CAR-T细胞疗法已经实现了5次技术迭代(图7)。技术的进步,也促进了产品的不断获批上市。
- 首先,当攻击肿瘤细胞时,CAR-T细胞可能会引起严重的副作用和毒性,这些副作用甚至是致命的。
- 其次,一些CAR-T细胞的细胞毒性不是肿瘤特异性的,可能会对正常组织造成损害。
- 第三,大多数CAR-T细胞产品的制造过程很耗时,这可能导致一些患者在细胞生成窗口期肿瘤进一步恶化。
- 此外,CAR-T治疗血癌的长期疗效仍需长期随访观察,而CAR-T细胞治疗实体肿瘤的应用尚需进一步研究。
这些挑战将决定未来整个T细胞工程领域的发展方向。
值得注意的是,在CRS的病理生理过程中,除了活化的CAR-T细胞外,内源性免疫细胞,如单核细胞、巨噬细胞和/或树突状细胞,也参与各种细胞因子的合成和释放以及加重临床CRS症状。
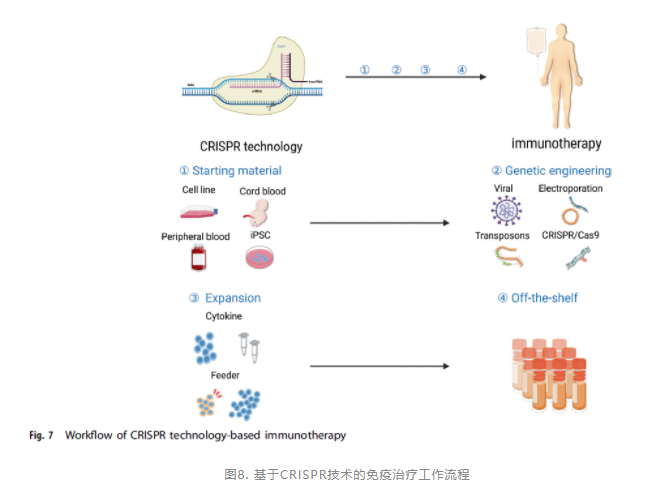
2020年,一项临床研究报告使用PD-1敲除T细胞治疗放疗和化疗无效的非小细胞肺癌患者;
这表明CRISPR工程在T细胞中是安全的,这为将CRISRP技术与其他T细胞修饰方法相结合铺平了道路。利用CRISPR介导的TCR和PD-1基因敲除进行的NY-ESO-1 TCR-T细胞治疗是临床上第一个经过进一步基因修饰测试的肿瘤特异性T细胞。
此外,CRISPR基因编辑系统允许异体T细胞治疗的更广泛应用。能够有效降低CAR-T的生产成本,价格能够得到有效降低,未来应用前景广阔。
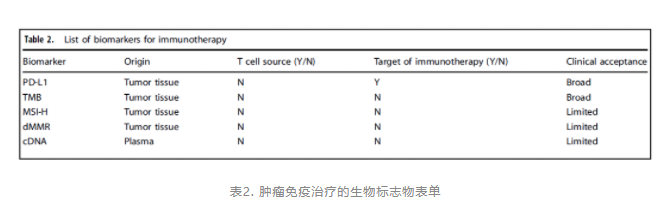
伴随诊断(companion diagnostic,CD)属于体外诊断范畴,应用于:一是确定最有可能从某种治疗产品中获益的患者;二是确定因使用特定治疗产品而可能增加严重副作用风险的患者;三是监测特定治疗产品对治疗的反应。包括:聚合酶链式反应(PCR)、荧光原位杂交(FISH)、免疫组化(IHC)、高通量测序(NGS)。伴随诊断技术的进步促进了更多Biomarker 的探索,包括ctDNA,TILs等。
最初探索ICB疗效的Biomarker是PD-L1,近年来研究的热点聚焦在MSI-H/dMMR上,因为MSI-H/dMMR肿瘤患者本身体内的肿瘤新抗原数量较多,理论上免疫是更为获益的。所谓的肿瘤新抗原,又称肿瘤特异性抗原(Tumor-specific antigen,TSA) ,是由肿瘤细胞产生的体细胞突变,且仅表达于肿瘤细胞,有比较强的肿瘤特异性和较高的免疫原性。能够产生新抗原的突变即为具有免疫原性的突变(immunogenic mutation)。
但由于MSI-H/dMMR整体患者的阳性率较低,在泛癌种领域的应用又缺乏大规模循证研究数据佐证,进展较为缓慢。
循环肿瘤基因(循环肿瘤DNA),即ctDNA( circulating tumor DNA),是近年来新发掘的一种预测免疫疗效的biomarker, ctDNA是指肿瘤细胞体细胞DNA经脱落或者当细胞凋亡后释放进入循环系统,是一种特征性的肿瘤生物标记。通过ctDNA检测,能够检出血液中的肿瘤踪迹。
加拿大癌症中心进行的一项前瞻性二期临床研究,涉及5种不同类型晚期实体瘤患者接受帕博利珠单抗治疗后,ctDNA水平变化与免疫效力之间的关系。结果显示,ctDNA水平与ICB的疗效是相关的。
尽管CAR-T细胞治疗B淋巴细胞白血病的初始CR率可能高达90%,但很大一部分患者会出现肿瘤复发。此外,并非所有淋巴瘤或多发性骨髓瘤患者都能通过CAR-T细胞治疗获得满意的疗效,这就促进了与CAR-T细胞疗法相关的Biomarker的研究。
最为相关的Biomarker应该是肿瘤抗原的表达,作为靶向治疗,CAR-T细胞的性质要求肿瘤细胞表达TAA以激发T细胞活性,这确实是CAR-T细胞治疗疗效的最关键的Biomarker。由于肿瘤抗原逃逸是CAR-T细胞治疗后肿瘤复发的主要机制,一些研究还表明,下调而不是完全丧失TAA,会抑制CAR-T细胞功能。
虽然可以设计CAR-T细胞来提高其对低水平TAA的敏感性,但TAA表达密度可能成为预测性Biomarker。
其次,不同CAR-T的产品特征也可作为预测性的Biomarker。治疗产品质量的不一致一直是自体CAR-T细胞治疗的主要挑战。患者提供的初始材料,经过多次治疗后,相关的特征一定会发生改变。因此,与健康献血者相比,肿瘤患者的T细胞亚群组成表现出更多的差异性。因此,产品质量的差异是影响临床结果的重要因素。
2018年,Kite Pharma评估了自家的多功能性CAR-T细胞产品,能够有效的在单细胞水平上产生多种细胞因子释放的能力,并与淋巴瘤的治疗效果相关。
其他一些研究,对输液产品的表型和转录组进行了分析,随着大规模研究的不断验证,这些产品特性可以作为有用的生物标记物,用于预测输液前的临床疗效。
(了解更多资讯,欢迎关注VXGZH:贝壳社)
参考资料:
1. Signal Transduction and Targeted Therapy (2022) 7:331.
2. Blood Reviews, 2016. 30(3): p. 157-167.
3. Journal of Controlled Release, 2020. 319: p. 246-261.
4. Am J Cancer Res 2020;10(7):1979-1992.


文章评论(0)