肿瘤精准治疗:新型治疗性抗体药物发展
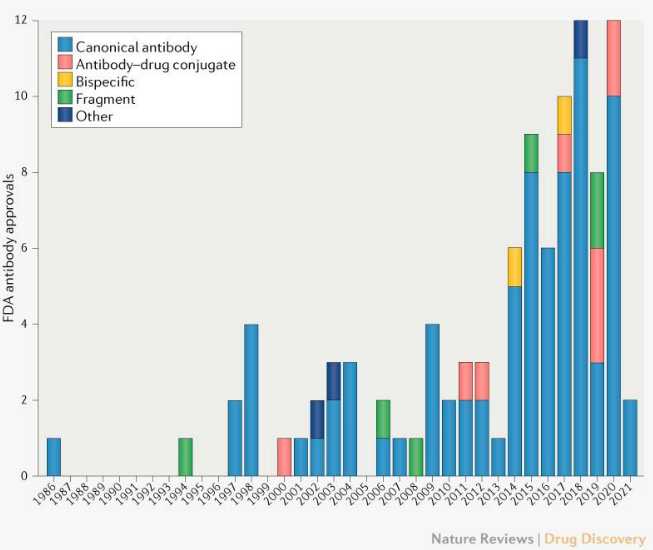
图1. FDA批准100种抗体
单克隆抗体可特异性结合靶抗原,通过发挥中和或促凋亡作用诱导细胞毒性,并促进先天免疫反应,如抗体依赖性细胞毒性(ADCC)、补体依赖性细胞毒效应(CDC)和抗体依赖性吞噬作用(ADCP)。免疫球蛋白G(IgG)型单克隆抗体、其他抗体形式(如抗体片段、双特异性抗体(BsAbs)和非IgG型免疫球蛋白)和抗体衍生物(如抗体偶联药物(ADC)和免疫细胞因子)已被广泛用于多种癌症的治疗。
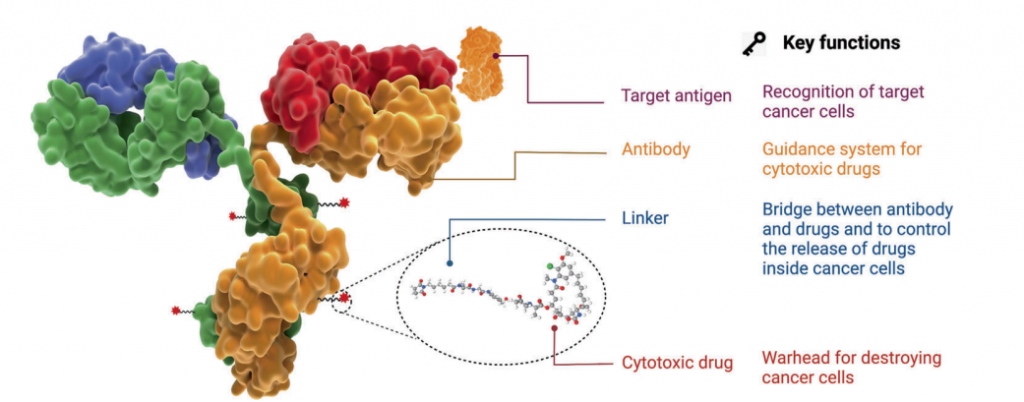
图2. ADC药物的结构和特性
通过将细胞毒性小分子化合物与单克隆抗体连接,产生新型抗体衍生物ADC,可以显著提高抗肿瘤效果。ADC可以选择性地直接递送高细胞毒性小分子药物以靶向癌细胞并诱导其凋亡,也意味着一个多世纪前Paul Ehrlich提出的 “魔法子弹”的设想成为现实。FDA已经批准了十多种用于癌症治疗的ADC,目前正在进行临床研究的ADC超过100种。除了小分子药物,抗体还可以与其他类型的分子结合,如寡核苷酸、放射性核素和蛋白质毒素。
利用人体免疫系统的功能正常表达在肿瘤治疗中的重要性正逐渐得到认可。BsAbs(双特异性抗体)可以同时结合两种不同的抗原。最广泛使用的BsAb是双特异性T细胞接合剂(BiTE),一端连接T细胞上的CD3,另一端识别目标肿瘤细胞上的蛋白质受体,从而激活T细胞以杀死肿瘤细胞。

图3. Blinatumomab作用机制
2014年,FDA批准了一种针对CD19和CD3的第一类BiTE,Blinatumomab,用于治疗复发和/或难治性B细胞急性淋巴细胞白血病(R/R B-ALL)患者。
抗体-细胞因子融合蛋白(也称为免疫细胞因子)代表了另一类基于抗体的免疫疗法。细胞因子发挥着强大的免疫调节作用,其对人类的生理和病理变化至关重要。但是在临床中,细胞因子治疗性药物的开发受到多种问题的阻碍,这主要是细胞因子免疫调节中的多态性以及非目标细胞(off-target)的激活导致的毒性和较短的半衰期。但是随着对细胞因子-受体相互作用的结构原理和功能信号的深入了解,通过蛋白质工程等方法对细胞因子进行人工修饰使得细胞因子成为药物越来越变的可能,如通过多种方法延长细胞因子的半衰期,或者是增加细胞因子靶向的特异性等。

图4. 免疫细胞因子疗法和靶点
目前与抗体融合细胞因子主要有IL-2,TNF,IL-15,IL-12,IFN,IL-4,IL-10,IL-21及IL-2+TNF。其中抗体融合IL-2相关免疫细胞因子研究的最早也最多,如较早开发的Hu14.18-IL-2 (anti-GD2+IL2)已经位于临床Ⅱ期,随后研究者将其中的IL-2进行低毒化改造(D20T)并构建NHS-IL-2LT ,目前该药也已经进入临床。除此之外,制药巨头罗氏也开发了针对IL-2的”免疫细胞因子”如CEA-IL2v和FAP-IL-2v,这些药物同样也已进入临床。
IgG是当前抗体药物中使用的主要抗体,但在某些情况下,全长链抗体在癌症治疗中的应用受到限制,因为这些大分子抗体,对实体瘤的渗透性差,并且Fc可以介导免疫系统的旁观者激活效应。随着抗体工程技术的进步,已经可以实现不同类型的抗体片段的生成(例如Fab、F(ab’)2)、工程抗体(例如单链可变(scFv)片段scFabs)和Ig结构域(例如VHH)。这些片段通常保留全长链抗体的抗原特异性,并有望显示出更好的穿透肿瘤和更少的Fc相关不良反应。此外,非IgG型蛋白,如亲和体(affibody)、设计的锚蛋白重复蛋白(designed ankyin repeat proteins,DARPins)和单体(monobodies),是有前景的治疗和诊断分子类别。
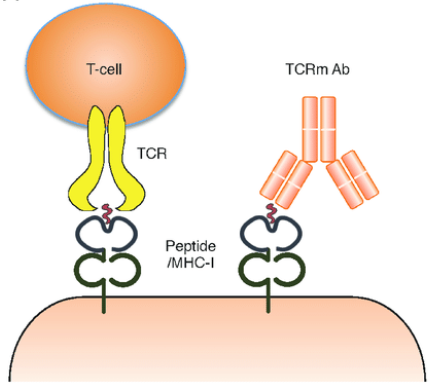
图5. T细胞受体模拟(TCRm)抗体
单克隆抗体通常识别细胞表面抗原,而大多数癌症相关蛋白存在于细胞内。T细胞受体(TCRs)可以通过与肽主要组织相容性复合物(pMHC)结合来识别细胞内蛋白质的某些小片段,该复合物包括源自细胞表面MHC环境中呈现的细胞内蛋白质中的短肽。一种模拟TCR表位可识别片段的抗体,称为TCR模拟(TCRm)抗体,TCRms用于靶向肿瘤细胞或其他细胞内的目标蛋白。TCRm将TCR的pMHC靶向能力与IgG mAb的稳健性相结合,有望提高药物敏感性。
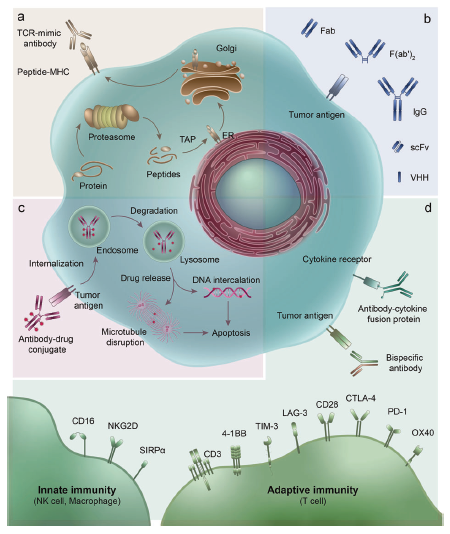
图6. 治疗性抗体及其衍生物
综上所述,具有代表性的治疗性抗体及其衍生物主要包括以下四类:
- TCR模拟抗体;
- IgG抗体和抗体片段;
- 抗体药物偶联物(ADC)及其作用机制;
- 多功能抗体,如双特异性抗体、免疫细胞因子(抗体-细胞因子融合蛋白)
接下来,我们简要梳理下四种类型产品的研究进展。

图7. ADC药物开发和批准过程中的重要事件
自2000年FDA批准第一款ADC 产品 Mylotarg®(gemtuzumab ozogamicin)以来,截至2021 年 12 月,全球共有14种ADC获得市场批准用于血液系统恶性肿瘤和实体瘤,此外,目前还有100多个ADC候选产品处于临床试验的不同阶段。
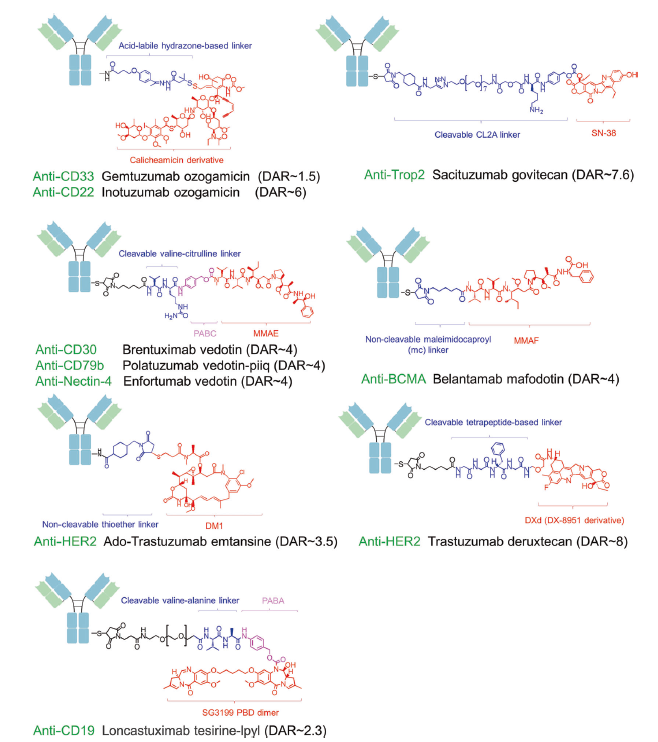
图8. FDA批准的抗体药物偶联物(ADC)示意图
目前,经批准的ADC药物的靶抗原通常是在癌细胞中过表达的特异性蛋白,包括实体瘤中的HER2、trop2、nectin4和EGFR,以及血液恶性肿瘤中的CD19、CD22、CD33、CD30、BCMA和CD79b。在肿瘤学和免疫学基础研究的推动下,ADC靶抗原的选择逐渐从传统的肿瘤细胞抗原扩展到肿瘤微环境中的靶点,例如基质和脉管系统。临床前和临床研究不断涌现出的新证据表明,新生血管系统、内皮下细胞外基质和肿瘤基质的成分可能是ADC药物开发的有价值的靶抗原。
- 使T细胞或其他免疫细胞(例如NK细胞)参与特异性消除肿瘤细胞;
- 桥接受体以阻断或激活协同信号通路;
- 靶向肿瘤细胞上的多种肿瘤抗原或不同抗原表位以提高肿瘤选择性。
而从结构形式上来说,多特异性抗体可分为两大类:IgG样抗体形式(具有Fc结构域)和非IgG样抗体格式(无Fc结构),如下图所示。
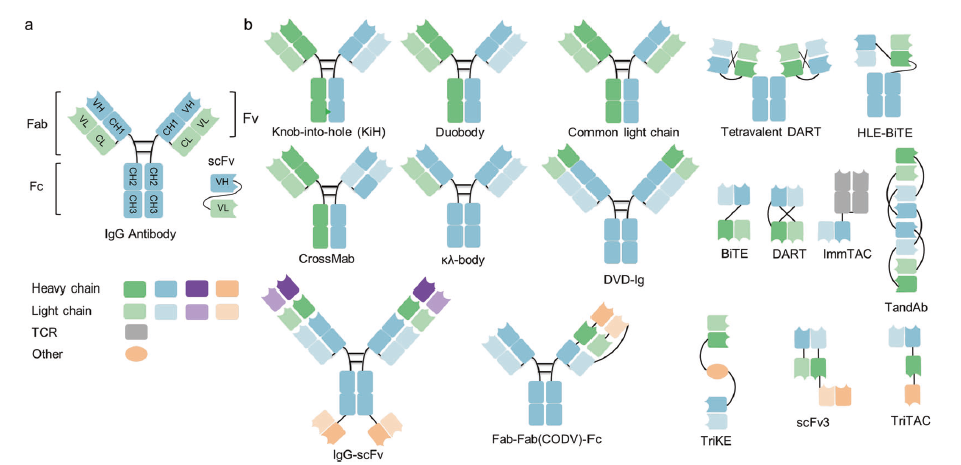
图9. 处于临床阶段的IgG抗体结构
和具有代表性的多特异性抗体示意图
全长IgG样多特异性抗体含有可与新生Fc受体FcRn结合的Fc结构域,表现出比抗体片段更好的药代动力学特征,并表现出多种抗肿瘤机制。Knobs into hole和CrossMab抗体工程改造技术,能够正确配对不同的Ig重链和轻链,实现稳定性。
与全长IgG样多特异性抗体相比,非IgG样多特异性抗体缺乏Fc结构域,因此具有较低的分子量,这使得其在实体瘤中的穿透效率更高。因此,没有Fc或蛋白结合结构域的抗体形式,由于肾脏清除率低,血清半衰期相对较短。无Fc结构域的非IgG样多特异性抗体可以潜在地用于防止先天免疫系统的非特异性激活,以及Fc介导的ADCC或CDC,这对于减少免疫细胞参与相关的副作用至关重要。
众所周知的多特异性抗体格式包括双可变结构域Ig、四价IgG样抗体、多特异性scFv、IgG scFv融合蛋白、多特性Fab、串联VHH结构域等。
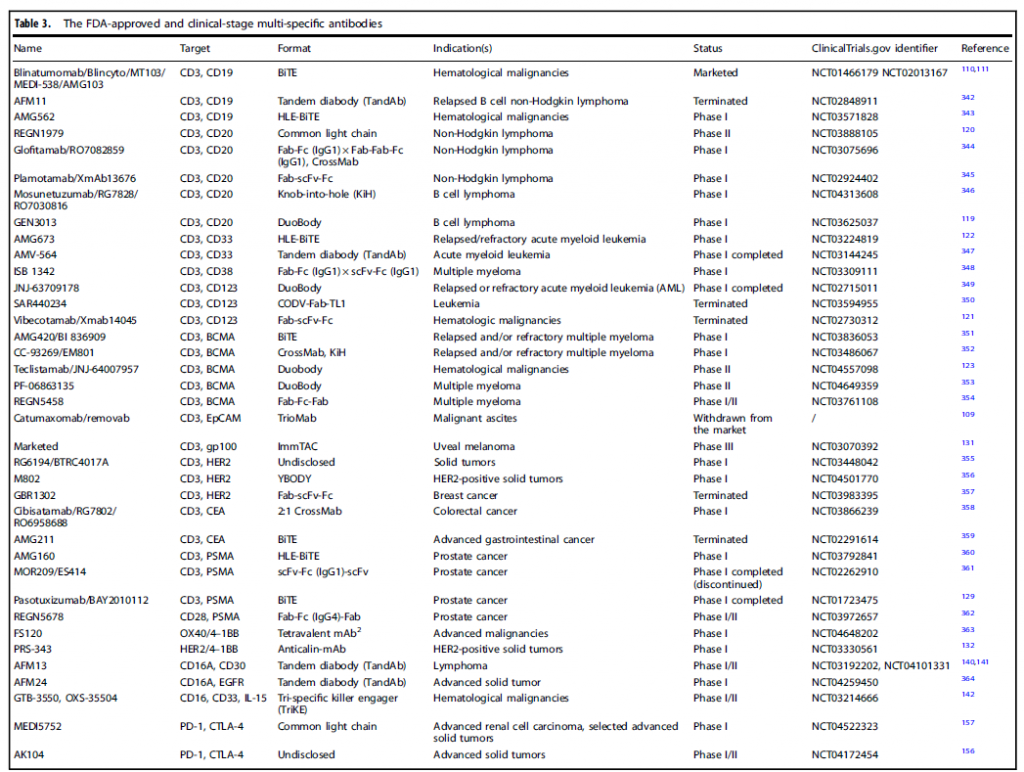
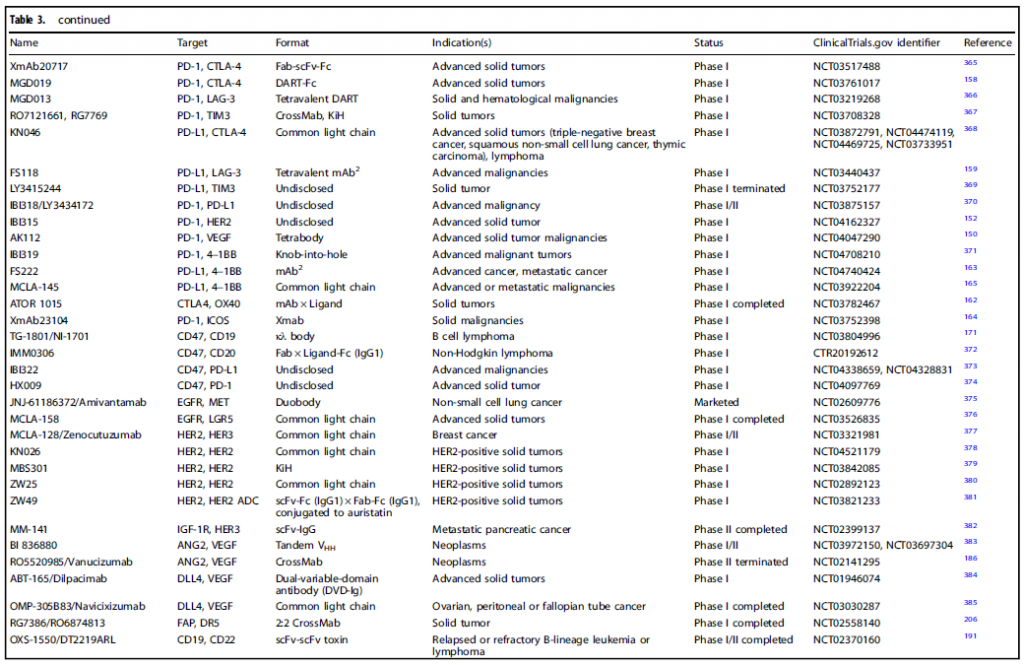
表1. FDA批准的和处于临床阶段的多特异性抗体
近十年来,全球每年新开的多特异性抗体临床试验数量逐年增加,目前正处于双抗药物研发的快速发展阶段。不完全统计,目前全球131个双抗药物处于国际多中心临床阶段。大部分多特异性抗体药物的临床研究还集中在I期和II期,少部分进入临床III期。从适应症来看,目前处于临床阶段的药物,88%布局肿瘤领域,其中实体肿瘤占比59%,血液瘤占比29%;其次是自体免疫疾病,占比8%。上图汇总了目前FDA批准的和处于临床阶段的多特异性抗体。
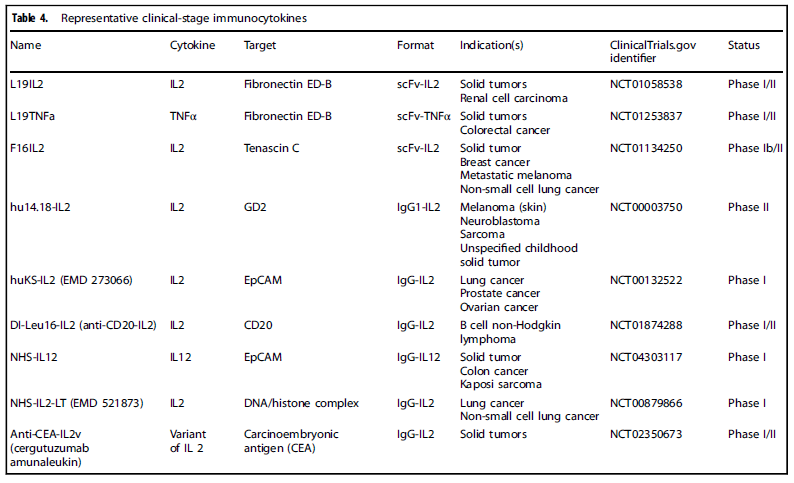
表2. 具有代表性的处于临床阶段的抗体-细胞因子融合蛋白
近几十年来,已经发现了多种抗体-细胞因子融合蛋白,它们可以根据其结构分为不同的类别,如下图所示。
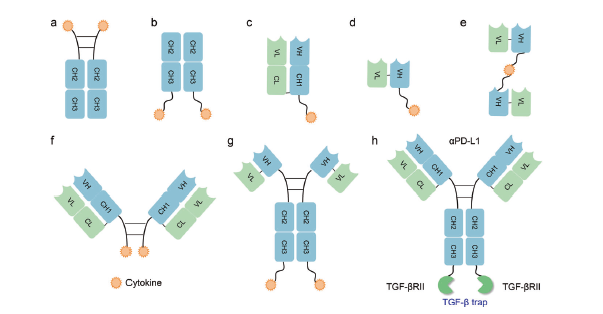
图10. 不同抗体或抗体片段细胞因子融合蛋白
a.融合到Fc结构域N末端的细胞因子;b.融合到Fc结构域C末端的细胞因子;c.与Fab的c末端融合的细胞因子;d.与scFv的C端融合的细胞因子;e.ScFv细胞因子ScFv融合蛋白;f.f(ab’)-细胞因子融合蛋白;g.IgG型免疫细胞因子,不含CH1和CL;h.代表性IgG格式免疫球蛋白Bintrafusp alfa(M7824)。一种双功能抗体融合蛋白,由抗PD-L1人IgG1和作为TGF-β陷阱的人TGF-βRII胞外结构域组成,尽管一个柔性甘氨酸丝氨酸连接体融合到IgG的CH3-C末端。Bintrafusp alfa阻断PD1-PDL1和TGFR2-TGFβ信号通路,以缓解免疫抑制并消除免疫抑制。
目前,关于超级细胞因子的研究大多处于临床前阶段。免疫细胞因子的研究起步较晚,但进展迅速。近年来,在中国和美国已经有几种免疫细胞因子制剂进入临床试验。新型免疫细胞因子的合成是基于细胞因子的免疫治疗的一个重要发展方向。衔接性细胞因子(Engager Cytokines)也可以理解为具有特定免疫细胞因子结构分子。目前,衔接性细胞因子的研究相对较少,但是该方向值得进一步研究。
- 减少了 Fc 相互作用导致的非特异性结合(许多细胞具有结合 Fc 区的受体);
- 在免疫沉淀和蛋白质印迹实验中,控制 Fc 与蛋白 A 或蛋白 G 结合;
- 更有效地穿透组织切片,改善免疫组织化学(IHC)染色;
- 减少大蛋白质表位的位阻,固相应用中抗原检测的灵敏度可能更高;
- 消除抗原抗体结合研究中与 Fc 相关的效应功能(例如补体固定);
- 利用 X 射线晶体学或 NMR 来研究免疫识别结构区,操作更简便
- 内源实验时的免疫原性低于完整抗体。
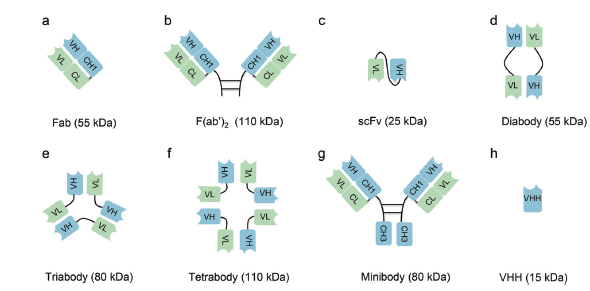
图11. 抗体片段及其衍生物的不同形式表
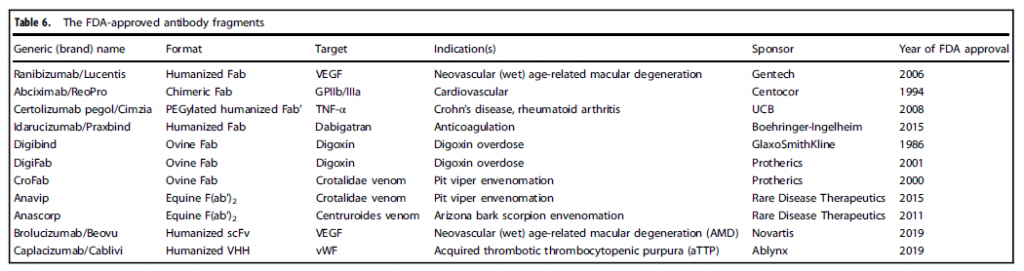
3. FDA批准的抗体片段
以上图表展示的是抗体片段及其衍生物的不同形式,以及FDA批准的抗体片段。
治疗性抗体的多功能化包括抗体衍生物(例如,ADC)和抗体融合蛋白(例如,多特异性抗体和免疫细胞因子)。ADC利用有效载荷诱导的细胞毒性功能,结合抗体的精确靶向能力,显示出改善的生物分布特征,通过多种作用机制攻击肿瘤细胞。可溶性TCR、TCRm抗体及其衍生物(例如ImmTAC分子)可以识别高度肿瘤特异性的HLA限制肽(例如p53和KRAS),既往这些靶点都被定义为“不可成药靶点”。
随着二代测序技术的快速发展,单细胞RNA测序、空间组学和综合生物信息学分析技术,能够深入和全面地了解恶性肿瘤组织,意味着基于抗体的细胞内抗原靶向和精确肿瘤治疗的时代的到来。
参考资料:
1. Mullard A. FDA approves 100th monoclonal antibody product. Nat Rev Drug Discov. 2021 Jul;20(7):491-495. doi: 10.1038/d41573-021-00079-7. PMID: 33953368.
2. Fu Z, Li S, Han S, Shi C, Zhang Y. Antibody drug conjugate: the "biological missile" for targeted cancer therapy. Signal Transduct Target Ther. 2022 Mar 22;7(1):93. doi: 10.1038/s41392-022-00947-7. PMID: 35318309; PMCID: PMC8941077.
3. Zheng X, Wu Y, Bi J, Huang Y, Cheng Y, Li Y, Wu Y, Cao G, Tian Z. The use of supercytokines, immunocytokines, engager cytokines, and other synthetic cytokines in immunotherapy. Cell Mol Immunol. 2022 Feb;19(2):192-209. doi: 10.1038/s41423-021-00786-6. Epub 2022 Jan 4. PMID: 35043005; PMCID: PMC8803834.


文章评论(0)