闯关FDA,中美双报,被拒之门外的创新药
FDA是全世界科学性最权威、水平最高、审核及管理最严格的食品及药品管理机构,任何一种药物,如果不能获得FDA的许可,是不可能作为药物在美国市场进行销售的。被FDA批准上市相当于药品拿到了全球通行证。然而,FDA严格的门槛,无形间将很多创新药拒之门外。
Omecamtiv mecarbil是一种新型的选择性小分子心肌肌球蛋白激活剂,作为同类首创(First-In-Class)的靶向肌节的在研新药,可直接靶向作用于心脏的收缩机制,在收缩过程中结合并增加与肌动蛋白相互作用的心肌肌球蛋白头部区域的数量。omecamtiv mecarbil旨在增加每个心动周期中的肌动蛋白-肌球蛋白活性横桥的数量,从而在射血分数降低的心力衰竭(HFrEF)患者中增强受损的心肌收缩力。临床前研究显示,omecamtiv mecarbil可增强心肌收缩力,且不增加心肌细胞内的钙浓度或心肌耗氧量。
2021年12月,箕星药业从Cytokinetics引进omecamtiv mecarbil的大中华区权益,箕星药业支付5000万美元预付款和2000万美元股权投资以及最高3.3亿美元的额外里程碑付款外加一定比例销售分成,协议总金额高达4亿美元。2022年11月,箕星药业和Cytokinetics已经在国内递交了omecamtiv mecarbil的上市申请,并获受理。
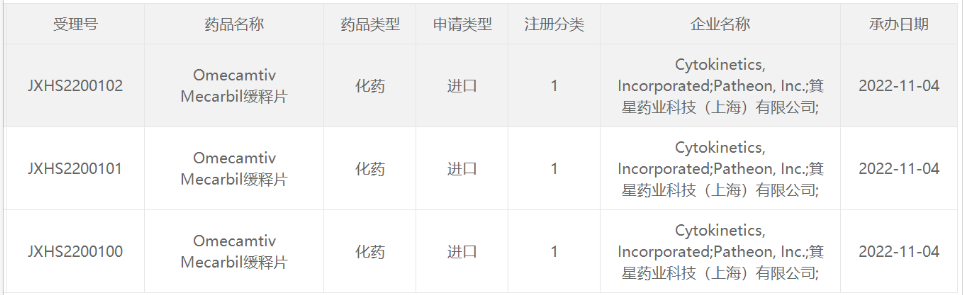
图源:药监局官网
据悉,自Cytokinetics公司首次开始开发omecamtiv mecarbil至今,已经历十五年的漫长研发征途。如今,Omecamtiv mecarbi在中国上市审批已启动,在美国FDA门前却吃了“闭门羹”,着实是无缘中美同步上市了。创新药的研发向来九死一生,此次omecamtiv mecarbil遭FDA拒绝,难免让Cytokinetics频增“壮志难酬”之感。再一次验证FDA的铁面无私,向来以以高标准、高要求来审批,全然无关于被审批药物投入多少的时间和财力物力。
Omecamtiv mecarbil被FDA拒绝主要是因为其临床数据有效性不足,FDA要求其进行一项额外的临床试验来建立Omecamtiv mecarbil的有效性证据。根据高特佳投资统计,近两年近30款药物上市申请被FDA拒的原因主要归纳为四点: 临床获益不明确,即有效性不足(46%); 安全性数据存疑,即药物毒副作用不耐受(12%); 缺乏国际多区域临床试验(MRCT,15%);药物生产记录及设施存在问题(27%)。
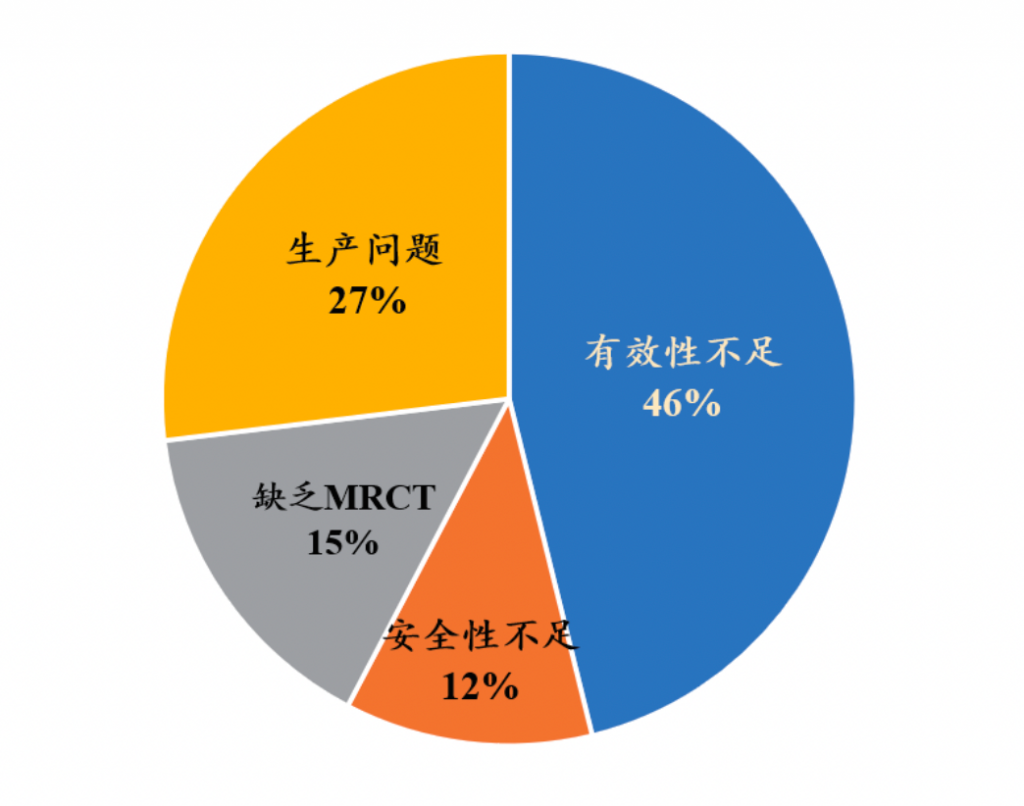
FDA新药上市申请拒批原因
来源:高特佳投资
据不完全统计,2022年FDA共批准37款新药,但至少也拒绝批准了19款药物,除少数几款新药FDA并未披露其被拒原因,其余有尽数一半被FDA拒绝都是因为临床获益不明确,有效性不足,从而被FDA要求进一步实验提供更有效的数据。
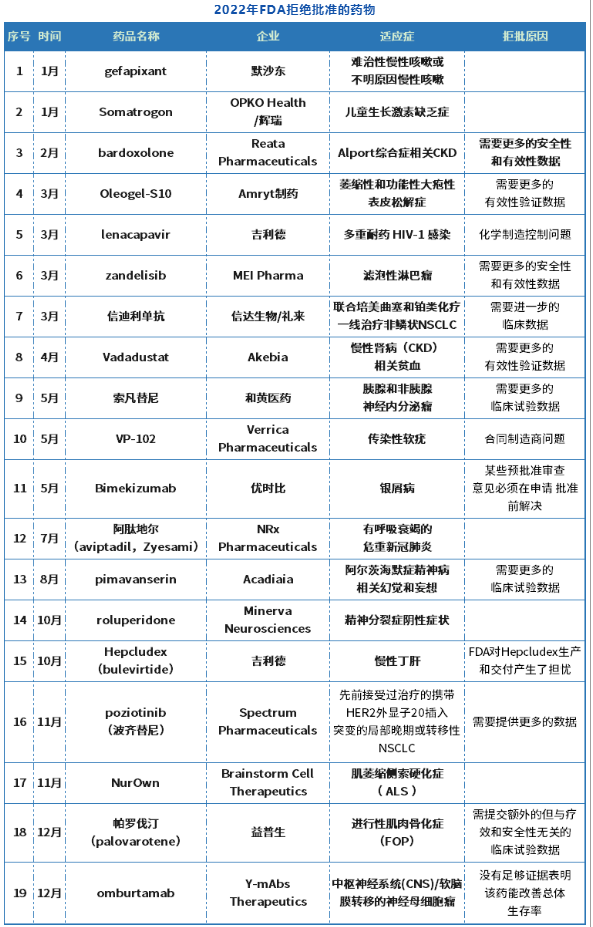
来源:药智头条
不难看出,这19款被拒药物中,出现了两款国产创新药的身影,即信迪利单抗和索凡替尼,且这两款新药在FDA碰壁的的原因竞相差无几:其中FDA拒绝批准信迪利单抗联合培美曲塞和铂类化疗用于非鳞状NSCLC患者一线治疗的BLA申请,FDA建议开展一项信迪利单抗联合化疗vs目前标准疗法一线治疗转移性NSCLC的多区域非劣效性临床试验,并以总生存期为主要终点;另外FDA拒绝了索凡替尼用于治疗胰腺和非胰腺神经内分泌瘤的新药上市申请,要求和黄医药开展纳入更多代表美国患者人群的国际多中心临床试验(MRCT)来支持美国获批。
我们知道信迪利单抗和索凡替尼均已在国内获批上市,这两款创新药之所以闯关FAD,是因为背后的本土药企不再局限于国内市场,而是积极参与全球竞争,尝试将自主研发的创新药“走出去”。
FDA作为全球最权威的药品管理机构,这四个被拒主要原因,也是FAD的“四大门槛”,任何一个国家的任何一款新药想要闯关FAD,减少碰壁几率,那毋庸置疑必须在如何跨过这四大门槛上下功夫了。近年来,国内药企对新药的定义由“中国新”提升到“全球新”,欲将每一款研发新药的版图拓展到其他国家,通过FDA审批获得“全球通行证”,是药企实现新药商业价值最大化的事半功倍的“捷径”,这也间接推动了中美双报的发展。
伴随着科技的发展、药物研发技术的进步,药品市场的日趋成熟,美国FDA的法规政策和针对药品的审评体系也在不断变化,国内药企需不断研究其变化,以便制定有利、有效的中美双报策略。来看Omecamtiv mecarbil、信迪利单抗和索凡替尼这三款新药,都是在国内获批上市,但是被FDA驳回,说明中国和美国在药品监管和要求上存在很多差异。
例如中美两国对于申报资料的要求不同,需要保证这套资料在药学(CMC)、非临床(临床前药理、毒理,Nonclinical)和临床(Clinical)方面同时符合两国的审评标准及技术要求。CDE关注安全性及有效性数据,FDA更关注体外安全性数据及动物实验数据。
中美创新药"双报”应在ICH框架下同步开展两国新药开发,研发尽可能满足两国的法规要求。其可行性建立在中美药品申报法规框架基本一致,但是在执行层面,中美还有明显差异。如美国的NDA批准大部分情况下要求有2项关键性研究,中国通常只要求1个美国接受全球的临床数据,中国只接受ICH成员国家的临床数据。中美双报前,药企首先要把握这些审核标准的不同,再重点斟酌试验如何设计、如何开展才能同时符合中美两地的标准。
此外,项目立项前期,进行立项调查时应该充分考察开发产品的临床需求,不仅包括中国市场,还应该考察美国甚至全球市场。由于疾病发病有一定的地域性特点,相同疾病在不同地区的发病率不同,药品的临床需求也会不同。例如,肝癌、食道癌在美国是罕见病,但在中国并不是,那么这两种癌症相关的药物在中美市场的临床需求完全不同。正如去年信迪利单抗和索凡替尼被FDA拒绝的原因如出一辙:被要求增加国际多中心临床试验。
尽管FDA对于新药审批逐渐严格,我国创新药在出海上也遇到了一些挫折,但仍有药物凭借优异的疗效及安全性优势获得FDA批准上市,如百济神州的BTK抑制剂泽布替尼、传奇生物的BCMA CAR-T疗法、石药集团高血压专利药马来酸左旋氨氯地平片等。
一款创新药的诞生往往非一朝一夕之功,期间风险和机遇并存。目前,我国仍处在由仿制药大国向创新药强国转变的时期,大多数企业的产品还是以仿制药为主,在创新药开发方面缺少经验。一个新药从发现到上市需要很长的时间,且期间还存在失败的概率。与此同时,企业的资金是否雄厚也是需要重点考量的因素,新药从发现到上市需要投入巨额资金,中美双报对公司的财力、时间投入都有较高的要求,企业在做决定时杜都需慎重考虑。
但是FDA一次的拒批并不代表这些药物的研发不成功,例如FDA拒批的部分药物却在欧洲或其他医药市场获批,如gefapixant在日本获批,Somatrogon在日本和欧洲获批,Oleogel-S10在欧洲获批。
对于国内创新药企来说,如果希望自己的药品走出国门,无疑要多总结以往药企们在FDA闯关的经验,时刻关注临床格局的变化,从药品可及性,疗效安全性、生产问题等方面全面提升自己的产品,我们也期待更多中国创新药走向世界。
参考资料:
1、《中美双报的概念、意义、现状与成果(上)》生物前哨,2023年2月20日
2、《接受药品境外临床试验数据的技术指导原则》CDE官网
3、《年度盘点:2022年19款药物遭FDA拒批;涉及默沙东、吉利德》药智头条,2023年1月19日


文章评论(0)