12:2反对,奥贝胆酸折戟FDA,NASH新药研发进展如何
1
另外,奥贝胆酸是全球第一个进入III期临床研究的NASH药物。2019年9月,基于REGENERATE关键临床III期研究第一次期中分析结果,Intercept提交奥贝胆酸治疗NASH的上市申请,不过由于组织学终点数据带来的获益仍具有不确定性,2020年6月,奥贝胆酸被FDA拒绝加速批准治疗NASH肝纤维化。FDA 建议Intercept提交REGENERATE III期临床研究的其他中期疗效和安全性数据。
今年1月,Intercept再次递交了奥贝胆酸在NASH适应症的NDA申请。此次申请主要是基于REGENERATE研究的第二次期中分析数据。REGENERATE是一项正在进行的多中心、随机、双盲、安慰剂对照的III期研究,共纳入2480例患者,旨在评估奥贝胆酸(10mg和25mg)治疗伴有肝纤维化的非肝硬化NASH患者的安全性和有效性。
第二次期中分析数据显示,接受奥贝胆酸(25mg,每日1次)治疗18个月时有22.4%的患者实现了纤维化程度至少改善1级且未出现NASH恶化,而安慰剂组达到该指标的患者只有9.6%(p<0.0001)。10mg奥贝胆酸组的数据与安慰剂组没有统计学差异。安全性方面,25mg组瘙痒发生率为55%,10mg组为33%,而安慰剂组为24%。目前,该研究正在进行中,以收集另一个主要终点全因死亡率和肝脏相关临床数据。
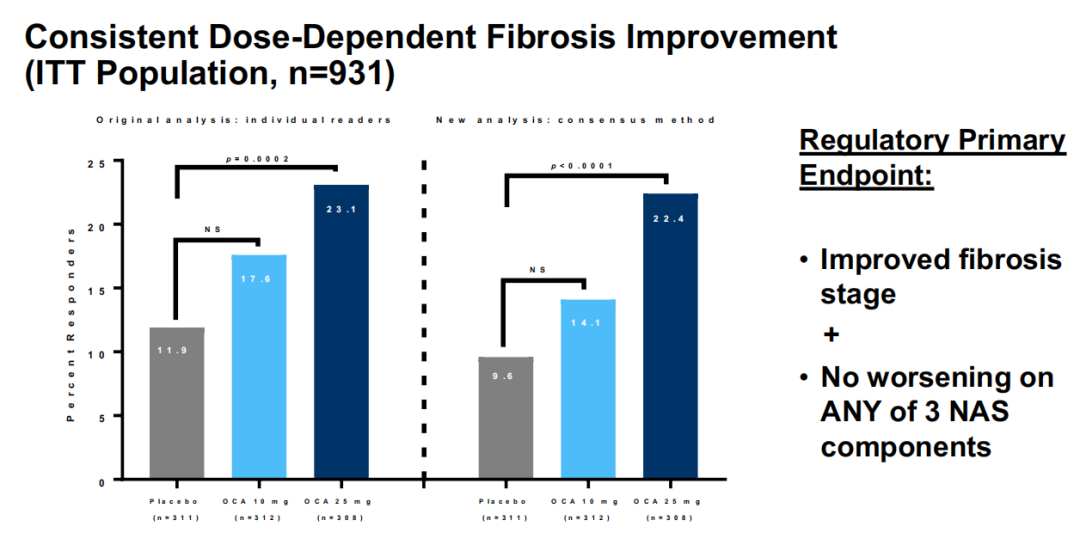
REGENERATE第二次中期分析数据
来源:Intercept官网
本次GIDAC会议主要对两个议题进行投票表决,分别为“从现有临床数据来看,2/3期NASH患者使用25mg OCA的获益是否大于风险”与“在对OCA的III期临床试验747-303(即REGENERATE试验)的临床结果保持密切关注的前提下,你支持‘依据现有数据加速批准OCA’还是‘推迟加速批准,直到747-303临床试验数据递交,届时可考虑传统途径批准’”。
最后,16位专家分别对两个议题进行了投票,针对第一个议题,16位专家中有12位不认可25mg OCA对NASH的获益,另有2位认可、2位弃权;针对第二个议题,16位专家中有15位认为应当推迟加速批准OCA的上市申请。
此次GIDAC会议上大部分的讨论都集中在安全性问题上。正如爱荷华大学教授Christopher Coffey的评价:“如果只看临床试验的数据,会觉得这款药物很有希望,但如果讨论风险获益问题,事情就会变得复杂。”
奥贝胆酸曾一度被认为有望成为首款获批上市的NASH药物,但其安全性问题一直遭到FDA的质疑。GIDAC会前,FDA披露的文件里就对奥贝胆酸25mg剂量组的不良反应表示了担忧,一方面,其不良反应可能会加剧NASH合并症的发生,另一方面,也会给有代谢综合征表现的患者带来新的合并症。此外,奥贝胆酸25mg组还有严重的“药物性肝损伤”信号。
目前来看,奥贝胆酸获批NASH适应症的前景非常不乐观。
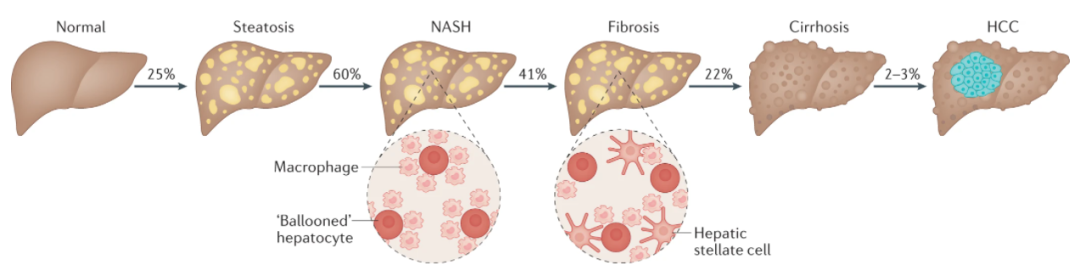
NAFLD的病理谱
来源:Nature Reviews Endocrinology
根据流行病学调查,全球的NAFLD患病率约为25%,其中10%—30%的患者最终会发展为NASH,这意味着全球NASH患者在1.9亿—5.8亿人之间。
据弗若斯特沙利文发布的预测数据,到2025年全球NASH药物市场将突破百亿大关,达到107亿美元,并于2030年达到322亿美元,复合年增长率41.8%和24.6%。然而面对百亿美元市场,目前只有印度批准了一款PPARα激动剂saroglitazar,NASH治疗领域有着巨大的未满足临床需求。
3
临床研究纷纷折戟的原因在于NASH的发病机制非常复杂,它与脂肪酸累积、胰岛素抵抗、免疫信号异常、炎症细胞等都有关系,其中最关键的致病途径仍旧模糊不清。
此外,许多NASH药物缺乏可靠的、无创的终点,而全球药监部门对NASH药物开发的临床终点有着严格的标准。如FDA规定NASH药物III期临床试验的替代终点必须采用肝穿刺活组织进行病理学评价,而影像学评价、血清学评价均不能作为NASH药物获批上市的主要终点。肝穿刺活检虽然是肝纤维化诊断的金标准,却存在创伤性、有并发症、存在取样误差等局限性,这进一步提高了NASH药物的研发难度。因此,NASH药物研发一直被视为药物研发领域的“黑洞”。
4
目前在NASH发病机理方面,最被广为接受的一种发病机制是二次打击假说:第一次对肝脏的打击来自酒精、肥胖、糖尿病等,这使得肝脏脂肪聚集;第二次打击是多种细胞或炎症因子导致脂肪酸过氧化,造成炎症、坏死和纤维化。针对其发病机制的复杂性,目前NASH靶向药物治疗策略主要可以分为四大类:第一类,靶向改善胰岛素敏感性的代谢靶点;第二类,靶向炎症或细胞损伤靶点,抑制炎症细胞的招募或阻断炎症信号传导;第三类,调节胆汁酸肠道肝脏循环和信号;第四类,改善肝纤维化。
与此同时,NASH的病理生理学的复杂性为NASH药物治疗提供了多个潜在的药物靶点,比如FXR、THR-β、FGF21、GLP-1R、PPAR、ASK1等。
其中靶向甲状腺激素受体(THR)-β的激动剂Resmetirom于近期公布了III期临床研究结果,是继奥贝胆酸后最接近撞线的一款NASH治疗药物。其III期临床研究MAESTRO-NASH结果显示,Resmetirom在NASH缓解且纤维化不恶化的主要终点上,高剂量组、低剂量组和安慰剂组的发生率分别为30%、26%、10%;在纤维化改善≥1级且NASH不恶化的主要终点上,三个组的发生率为26%、24%、14%;在次要终点LDL-C降幅上,三个组分别为-16%、-12%、1%。
研究显示,Resmetirom不仅能够缓解NASH,还具有降低心血管风险的治疗潜力。同时,Resmetirom在安全性方面也较好,高低剂量组均显示出了良好的耐受性,许多患者接受治疗时间超过一年。Madrigal计划于今年上半年提交Resmetirom用于非肝硬化NASH伴肝纤维化治疗的新药上市申请。
国内方面,拓臻生物开发的靶向THR-β靶点的TERN-501已进入Ⅱ期临床,此外拓臻生物还开发了FXR激动剂TERN-101、VAP-1抑制剂TERN-201等。
歌礼制药的THR-β激动剂ASC41和ASC43F分别进入临床II期、I期研究阶段。此外,歌礼制药还研发了FXR激动剂ASC42,其用于治疗原发性胆汁性胆管炎的临床试验申请已获FDA批准。
众生药业作为国内布局NASH新药较多的企业,已布局5款NASH药物,其中ZSP1601已处于IIb期临床研究阶段,此外还有ZSP0678、RCYM001、RAY001和RAY002。
雅创医药的HPG-1860、东阳光药的HEC96719、四环医药/轩竹生物的 XZP-5610等多款NASH新药也已进入临床阶段。
除了以上专攻NASH靶点的产品外,与糖尿病适应症相关的治疗药物也往往是NASH适应症的候选药物的方向。如先为达生物有多款GLP-1受体激动剂在进行NASH适应症的研究;微芯生物自主研发的全新机制降糖药西格列他钠(PPAR 全激动剂)也在进行NASH适应症的研发。
NASH是一种多因素、进行性的复杂疾病。自1980年被提出以来,针对NASH的药物研发已经开展了几十年,但大量的项目倒在了临床开发阶段,NASH也因此成为医药界的研发黑洞。尽管如此,仍有很多药企在NASH新药研发之路上继续前行。根据clinicaltrials.gov登记的临床研究,全球大约有 650多项针对NASH的临床试验(研究状态包括正在进行、撤回、终止或完成)。未来谁将拔得头筹,我们拭目以待。
参考资料:
1. https://endpts.com/fda-committee-votes-against-approval-of-intercepts-nash-drug/;
2. https://www.fiercepharma.com/pharma/intercepts-nash-dreams-crash-after-fda-expert-panel-votes-against-ocalivas-benefit-risk;
3. Pfister D, Núñez N G, Pinyol R, et al. NASH limitsanti-tumour surveillance in immunotherapy-treated HCC [J]. Nature, 2021;
4. 《研报分享丨NASH药物:百亿市场下一城》,BioBAY Plus,2023-01-06.


文章评论(0)