从辉瑞Sisunatovir在国内申报临床,浅谈RSV领域研究进展
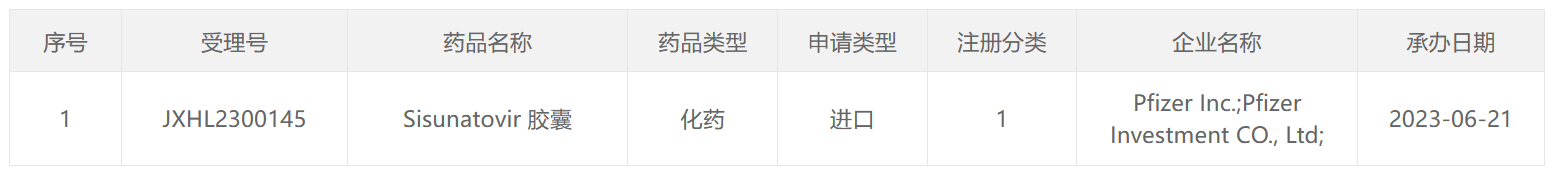
Sisunatovir由ReViral研发。2021年3月,ReViral与联拓生物达成独家合作和许可协议,授权后者在中国大陆、香港、澳门和新加坡地区共同开发和商业化Sisunatovir。2022年4月,辉瑞斥资5.25亿美元通过收购ReViral将Sisunatovir纳入囊中。2022年12月,辉瑞与联拓生物(lianbio)达成战略合作,又从联拓生物手中获得Sisunatovir在中国大陆、香港、澳门和新加坡地区的开发和商业化权利。
此次Sisunatovir在国内申报临床,意味着其在国内迈出重要一步,期待未来Sisunatovir可以顺利在国内获批上市在,造福广大RSV感染患者。
RSV感染对于成年人来说症状类似感冒,表现为头疼、发炎等。但对婴幼儿或老年人等群体来说,RSV感染可能是致命的。据统计,2020年全球5岁以下儿童RSV严重感染发病人数达到约3400万人,全球65岁以上老年人严重感染发病人数达到约490万人。而每年因RSV感染死亡的儿童和老年人患者数量分别高达16万和1.4万。
目前,全球已批准多款RSV预防药物,包括RespiGam、Synagis(palivizumab,阿斯利康)、Beyfortus(nirsevimab,赛诺菲/阿斯利康)、Arexvy(RSVPreF3 OA疫苗,GSK)和Abrysvo(RSVpreF,辉瑞)。其中RespiGam是含有高滴度RSV中和抗体的免疫球蛋白,是各种抗体的混合物,1995年被FDA批准用于2岁以下高风险新生儿的RSV预防。
Synagis和Beyfortus均属于单克隆抗体。其中Synagis是一种人源化的鼠单克隆抗体,通过结合病毒表面上的RSV融合蛋白而阻断膜融合过程,1998年6月被FDA批准用于支气管肺发育异常的婴幼儿、早产婴幼儿和血液动力学异常的先心病儿童预防下呼吸道RSV感染。Synagis仅限于高危婴儿,且只能提供一个月的保护,需要注射5次才能覆盖一个典型的RSV流行季。Beyfortus是一款长效单克隆抗体,专为所有婴儿设计,2022年11月被欧盟批准作为单剂量,用于所有婴儿,在第一个RSV季节预防下呼吸道感染(LRTI)。
Arexvy和Abrysvo均属于RSV预防性疫苗,被批准用于预防60岁及以上人群因RSV引起的LRTI。其中Arexvy由RSV融合前F糖蛋白(RSVPreF3)与GSK专有的AS01佐剂组合而成。Abrysvo是一种非佐剂二价疫苗,含有来自RSV-A和RSV-B的稳定preF蛋白亚基。
市场表现上,RespiGam由于制备、使用不便,2003年被停用。Synagis市场表现不错,2008年后连续7年销售额超过10亿美金,但存在价格昂贵、预防持续期短、患者覆盖面窄等缺点。
Beyfortus是全球首个且唯一、可广泛应用于新生儿及婴儿的RSV预防药物,一针即可在长达5个月的RSV流行季(每年10月中至3月中)为婴幼儿提供持续保护。赛诺菲和阿斯利康计划在2023/2024年冬季推出Beyfortus,据悉其定价在600美元,预计其2026年销售额有望超过8亿美元。
Arexvy预计将于今年秋季在美国药房、诊所和其他医疗机构提供,有分析师估计到2030年其销售额峰值有望达到25亿美元。Abrysvo获批较Arexvy晚,但其通过对孕妇进行主动免疫,预防6个月以下婴儿由RSV引起的下呼吸道和严重下呼吸道疾病的BLA正在美国接受优先审查,其市场潜力不可小觑。
此外,目前全球还有多款预防RSV感染的药物或疫苗进入3期临床,如Moderna的mRNA-1345、Bavarian Nordic的MVA-BN RSV。其中mRNA-1345是一款编码病毒稳定融合前F糖蛋白的mRNA疫苗,曾被FDA授予突破性疗法认定,用于预防60岁或以上成年人因RSV引起的LRTD。2023年1月,Moderna宣布mRNA-2345的3期临床达到主要终点,数据显示其预防RSV相关LRTI的效力达到83.7%。基于此数据,Moderna计划在2023年上半年递交监管申请。
MVA-BN RSV是一种基于MVA-BN载体的疫苗,能够进入哺乳动物细胞,表达病毒蛋白,但不能复制。MVA-BN RSV表达5种不同的RSV抗原,能够同时覆盖A型和B型RSV,这也是MVA-BN RSV与其他在研RSV疫苗的不同之处。
2023年4月,Bavarian Nordic宣布MVA-BN RSV全球3期临床试验已完成主要疗效分析所需的病例数积累,预计将于今年中完成该疫苗3期临床试验的主要疗效分析。经裁定的数据已经证实有足够的病例具有符合实验要求的2+和3+症状。
其中爱科百发的齐瑞索韦进展最快,目前已在国内申报上市。齐瑞索韦是一种结构新颖的RSV融合蛋白小分子抑制剂,通过与病毒的融合蛋白结合阻止病毒侵入人体细胞,防止感染引起的疾病,同时该药还可以阻止病毒通过细胞与细胞间的融合(即形成“合胞体”,一种RSV感染细胞的特征),从而实现抗病毒效果。
齐瑞索韦最早由罗氏开发,2014年1月爱发百科获得其全球权益。已公布的多中心1/2/3期临床研究数据显示:齐瑞索韦单剂量和多剂量给药均可显著减轻患者的临床症状,且显示出快速、优异的抗病毒效果;而且在RSV重症高风险危险人群,即6个月以下的婴幼儿中,齐瑞索韦也展现出更显著的临床获益;同时齐瑞索韦的耐受性很好,具备极高的安全性特征,未出现任何严重不良事件。
同时,齐瑞索韦显示了明显的抗病毒效果:齐瑞索韦组在治疗第5天的病毒载量与对安慰剂组相比进一步降低77%;并且在整个治疗期间,齐瑞索韦组相对安慰剂组的病毒载量有显著降低。
2022年12月,齐瑞索韦的上市申请获CDE受理,而且其治疗RSV引起的2岁及以下儿童呼吸道感染的上市申请先后被CDE纳入优先审评。
先为达生物的XW001是一种干扰素λ的吸入溶液,其在人源干扰素λ 1的基础上,经蛋白质工程优化,使得雾化吸入给药更加稳定。XW001具有独特的广谱抗病毒优势,临床前研究显示其可显著降低呼吸道合胞病毒、流感病毒、偏肺病毒等的复制。目前,XW001已进入2期临床。
君实生物/旺山旺水的VV116是一款新型口服核苷类抗病毒药物,其片剂已于2023年1月29日获NMPA附条件批准用于治疗轻中度COVID-19成年患者,其干混悬剂于今年5月在国内获批临床,用于RSV感染。临床前体内药效研究显示:VV116在RSV多个敏感细胞系上具有优异的抗病毒效果。
此外,近年来国内多款RSV产品取得新进展:强生人RSV融合蛋白抑制剂JNJ-53718678(Rilematovir )口服混悬液于2021年3月被CDE纳入突破性治疗品种,用于治疗儿童呼RSV所致中重度呼吸道感染;优锐医药超2亿美元引进的新型RSV疫苗MVA-BN-RSV于2022年11月在国内获批临床;君实生物/旺山旺水的VV116干混悬剂、GSK的重组RSV疫苗(AS01E 佐剂系统)先后于今年5月和6月在国内获批临床。
而且,(据不完全统计)今年以来两款RSV药物临床试验取得可喜进展:5月艾棣维欣RSV疫苗ADV110(BARS13)的1期临床数据荣登《Vaccines》学术期刊。ADV110 是艾棣维欣自主研发的一种 RSV 重组蛋白亚单位疫苗,并运用了公司研发的创新佐剂 AE011。1期临床试验结果显示:ADV110 疫苗具有良好的安全性和耐受性,其在免疫接种后可在机体诱导产生高水平的抗体,表现出良好的免疫原性;6月三元基因宣布其人干扰素α1b雾化吸入治疗小儿RSV性下呼吸道感染的3期临床研究,已按照临床试验方案要求进行揭盲后的统计分析并获得积极结果,试验达到预设的主要研究终点。
除了上述企业,我国还有多家企业布局RSV领域,其中沃森生物/蓝鹊生物RSV mRNA疫苗、智飞生物RSV组合疫苗、石药集团RSV疫苗等均处于临床前阶段。期待未来国内外领域均有更多的RSV相关药物获批上市,用于预防或治疗RSV感染。


文章评论(0)