多款产品持续上量,百济神州的商业化布局进阶路
今年7月,百济神州宣布与诺华分手,重新获得欧司珀利单抗(TIGIT靶点)的全部全球权利。事实上,百济神州在公告中表示此次终止协议不会影响前期已从诺华收到的3亿美元的现金首付款,且针对另一款优势产品百泽安(替雷利珠单抗)的海外商业化“已经搭建起基础销售团队”。虽然海内外针对TIGIT靶点的开发颇多困难,但该靶点潜力巨大。所谓“祸福相依”,百济神州此次终止合作,或有正向结果——通过自研自产自销,收获更多商业价值。届时,欧司珀利单抗成功上市,或将成为百济神州继BTK小分子抑制剂“百悦泽”、PD-1抗体免疫疗法“百泽安”、 PARP1/PARP2小分子抑制剂“百汇泽”之后,又一重磅产品。
更多适应症持续推进中
“终止”之外亦有“突破”。9月19日,百济神州宣布其抗PD-1抗体百泽安(替雷利珠单抗)获得欧盟委员会批准,作为单药用于治疗既往接受过含铂化疗的不可切除、局部晚期或转移性食管鳞状细胞癌(ESCC)的成人患者。替雷利珠单抗也成为国产PD-1首款出海产品,打响国产PD-1出海第一枪。
无独有偶。紧接着,国内首个获批的国产PD-1——君实生物的特瑞普利单抗也传来出海好消息。10月27日,君实生物的北美合作伙伴Coherus BioSciences宣布,特瑞普利单抗获FDA批准在美上市,联合吉西他滨/顺铂一线治疗晚期复发或转移性鼻咽癌(R/M NPC)患者;单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗。
PD-1赛道向来火热,目前国内已经基本形成“国产PD-(L)1五强”格局,五强选手中,除了百济神州及君实生物,还有恒瑞医药、信达生物及复宏汉霖。获批适应症方面,截至2023年上半年,国内获批适应症最多的是百济神州的替雷利珠单抗,共计11项;其次是恒瑞医药的卡瑞利珠单抗,9项;信达生物的信迪利单抗,7项;君实生物的特瑞普利单抗,6项;复宏汉霖的斯鲁利单抗,4项。另外进口的O药纳武利尤单抗7项,K药帕博利珠单抗10项。可以看出,百济神州的替雷利珠单抗获批癌种及适应症在国内市场位居国产PD-1药物第一。
销售方面,2023年前三季度,百济神州替雷利珠单抗为21.79亿元,君实生物特瑞普利单抗为6.68亿元,信达生物信迪利单抗16.31亿元。恒瑞医药未公布具体情况,但有分析指加上阿得贝利单抗,恒瑞医药的PD-(L)1销售额将冲向国内第一。另外,业内分析,复宏汉霖的斯鲁利单抗2023年度销售额将突破10亿元。按目前情形,百济神州在PD-(L)1销售额上处于领先地位。
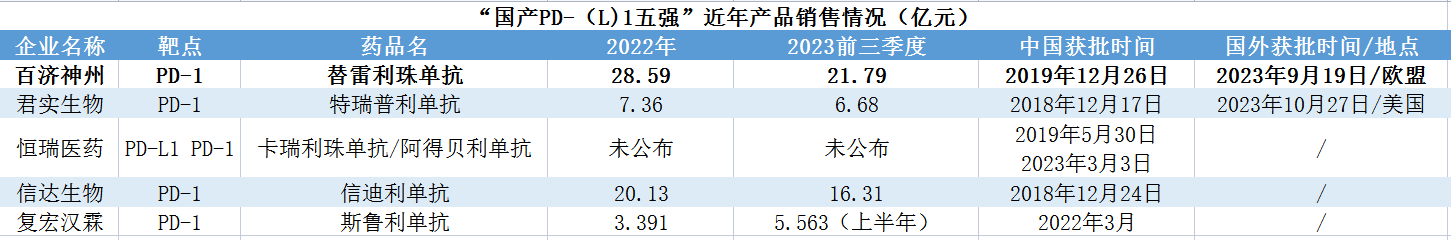
数据来源:公开资料,贝壳社制图
替雷利珠单抗还是获批纳入国家医保药品目录适应症数量最多的PD-1抑制剂,11项获批适应症中,9项纳入国家医保目录。此外,用于治疗一线不可切除或转移性肝细胞癌(HCC)(年内有望获批上市)、联合氟尿嘧啶类和铂类药物化疗用于一线治疗局部晚期不可切除的或转移性的胃或胃食管结合部(G/GEJ)腺癌患者的新适应症正在接受CDE的技术审评,联合依托泊苷和铂类化疗用于一线治疗广泛期小细胞肺癌(ES-SCLC)患者的新适应症上市许可申请已获CDE受理。
在海外,除了欧盟获批上市,百济神州还同时递交了替雷利珠单抗在美国、澳大利亚、新西兰、日本、韩国、泰国等国的上市申请,申报适应症包括食管鳞癌(ESCC)、非小细胞肺癌(NSCLC)等。此外,替雷利珠单抗已在超30个国家和地区开展超20项注册相关的试验,入组患者超1.2万人。未来,百济神州的替雷利珠单抗将会有更多出海好消息。
除百泽安(替雷利珠单抗),百济神州还有BTK小分子抑制剂“百悦泽”、 PARP1/PARP2小分子抑制剂“百汇泽”两款优势产品,持续为百济神州带来业绩增量。其中泽布替尼(百悦泽)在2019年便已实现出海。
帕米帕利未来可期
泽布替尼在全球超过65个市场获批多项适应症,更多适应症不断推进中。今年10月20日,NICE(英国国家卫生与临床优化研究所)推荐泽布替尼用于未经治疗的伴有17p缺失或TP53突变(高风险)的慢性淋巴细胞白血病(CLL),或未经治疗的无17p缺失或TP53突变,且不适合接受氟达拉滨-环磷醯胺-利妥昔单抗(FCR)或苯达莫司汀联合利妥昔单抗(BR)治疗的CLL,以及复发╱难治性CLL成人患者。其实早在2022年7月,泽布替尼就曾获NICE认可其在治疗华氏巨球蛋白血症(WM)中独有的成本优势。今年5月,泽布替尼还获加拿大卫生部批准用于治疗慢性淋巴细胞白血病(CLL)成人患者,等等。
据弗若斯特沙利文分析,全球BTK抑制剂市场2025年将达到192亿美元,2030年将达到251亿美元,复合年增长率5.5%。中国BTK抑制剂市场2025年将增至103亿元,复合年增长率58.6%。
与全球趋势保持一致,泽布替尼的销售额增长迅猛,不容小觑,已成为百济神州回血大单品。2020年,泽布替尼全球销售额2.69亿;2021年,14亿元;2022年,达38.29亿元(美国销售额26.44亿元);2023上半年,36.12亿元(美国销售额25.19亿元)。2020年,中国销售额1.6亿元;2021年6.52亿元;2022年10.15 亿元;2023年上半年6.69亿元。百济神州表示,将继续巩固泽布替尼在中国BTK市场的领导地位。
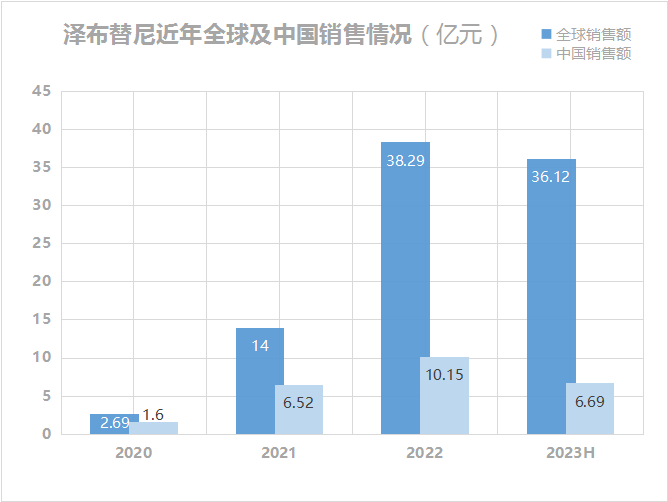
数据来源:公开资料,贝壳社制图
百济神州第三款自主研发的商业化产品——PARP1/PARP2小分子抑制剂百汇泽(帕米帕利)于2021年5月上市,用于既往经过二线及以上化疗的伴有胚系BRCA(gBRCA)突变的复发性晚期卵巢癌、输卵管癌或原发性腹膜癌患者的治疗,2021年底纳入国家医保目录。与替雷利珠单抗及泽布替尼销量猛增不同,帕米帕利2022年销售额仅3561万元,同比下滑25%。不过,鉴于百济神州前两款自主研发药物的高歌猛进,以及帕米帕利正在全球开展的十余项临床试验,其未来是可期的。
除前文所述三款自主研发实现商业化的产品外,包括开头提到终止合作的欧司珀利单抗,百济神州还有多款自主研发产品正不断推进临床,极富潜力。
更多原创药加码中
百济神州称欧司珀利为“当前开发进程中最先进的抗TIGIT抗体之一”,截至2022年底,欧司珀利已经开展适应症包括肺癌、肝癌、宫颈癌、食管鳞癌等8项全球临床试验。在研发费用上,百济神州2022年对于欧司珀利的投入占营收的7.49%,仅次于重磅单品泽布替尼的8.92%。与诺华分手之后,欧司珀利前路几何,还有待观察。
百济神州其他自主研发产品还有:
HER2双抗泽尼达妥单抗(zanidatamab,ZW25)。11月2日,百济神州申报的注射用泽尼达妥单抗拟获CDE纳入优先审评,用于既往接受过全身治疗的HER2高表达的不可切除局部晚期或转移性胆道癌患者。在今年6月的美国临床肿瘤学会(ASCO)年会上,百济神州报告了该产品治疗既往经治的HER2扩增性胆道癌的关键性2b期HERIZON-BTC-01研究的结果:在一线治疗难治性HER2阳性胆道癌患者中表现出快速、持久的反应和可控的安全性。
BGB-11417,一款Bcl-2小分子抑制剂,可与泽布替尼联合用药,潜力巨大。BGB-15025,一款HPK1小分子抑制剂,计划在2023年取得2期推荐剂量(RP2D)用于开展单药治疗的临床试验,后续开展与替雷利珠单抗联合的剂量扩张试验。BGB-16733,一款靶向BTK的PROTAC药物,目前全球尚无成药的靶向BTK的PROTAC药物,该药1期临床试验正在入组患者,进度处于前列。
凭借创新药成功出海+高额收入+高研发投入,百济神州的发展将会驶入快车道。而作为上层施政者,亦应该考虑中国创新药的“价格保护”,促进行业良性循环、助力本土企业全面出海。届时,以百济神州等为主的中国创新药企业,将真正做到“从大到强”,惠及更多患者,彰显中国医药力量。
参考资料:
1.《百济神州:百悦泽获英国国家卫生与临床优化研究所推荐用于治疗慢性淋巴细胞白血病成人患者》,智通财经,2023-10-21.
2.《百济神州2023H1:药物销售67亿元,泽布替尼大卖36亿元》,极目新闻,2023-08-04.
3.《年研发支出超百亿,6年亏逾470亿,创新药龙头百济神州何时扭亏? 》,金融投资报, 2023-04-26.
4.《百济神州年报两大看点:百悦泽销售额大增159%,百泽安稳居国内PD-1第一梯队》,一度医药, 2023-02-28.


文章评论(0)