中国创新药欧美上市高潮来袭?
早在去年12月,和黄医药就已向FDA滚动提交呋喹替尼用于治疗难治性转移性结直肠癌的新药上市申请。今年3月,和黄医药完成滚动提交上市申请,同月,和黄医药找到了合作方,与日本武田药品工业株式会社达成独家许可协议,进一步推动呋喹替尼在中国以外地区的全球开发、商业化和生产。今年5月,呋喹替尼在美国的上市申请获得受理,并获批给予优先审评。
此次在FDA获批,较原定的处方药用户付费法案(PDUFA)目标审评日期2023年11月30日提早了超过20天,目前和黄医药将于2024年相继推进呋喹替尼在欧洲、日本上市,相信成功打开了FDA大门的呋喹替尼,进一步获得其他国家药监局入场券将指日可待。
从2018年12月获NMPA批准在中国上市至今已经6年,在中国,特瑞普利单抗已获批了6项适应症,覆盖鼻咽癌、黑色素瘤、尿路上皮癌、非小细胞肺癌、食管鳞癌等。其中,联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗,早在2021年11月便在国内获批,并获得FDA授予2项突破性疗法认定和1项孤儿药资格认定。
2020年12月,特瑞普利单抗首次通过国家医保谈判,目前已有3项适应症纳入《2022年药品目录》,是国家医保目录中唯一用于治疗黑色素瘤的抗PD-1单抗药物。
可以说,特瑞普利单抗本身确实足够优秀,获得FDA批准之后,相关适应症在欧盟和英国监管机构的上市申请也正在审评中。
在国内,替雷利珠单抗已有11项适应症获批,其中9项适应症被纳入国家医保目录,已在国内获批的适应症涵盖非小细胞肺癌、肝细胞癌、鼻咽癌、膀胱转移性恶性肿瘤等。此外,替雷利珠单抗的一线肝细胞癌适应症有望今年在国内获批上市,根据药监局官网,目前已进入在审评审批状态。
目前,FDA也受理了替雷利珠单抗的上市许可申请,用于一线治疗不可切除的局部晚期、复发或转移性的ESCC患者。
自主出海即中国药企凭借自身的团队在海外国家和地区开展临床试验,申报上市,获批后展开销售。但自主出海的难度更高,美国作为全球药品监管水平最高且新药销售额最高的国家,不管是美国本土药企,还是其他国家的药企,新药研发成功在美国市场上市是很多药企的目标,很多企业自主出海第一步便是获得FDA的认可。
据统计,我国已由10款创新药物闯关FDA,其中PD-1药物就有4款,分别来自恒瑞医药、信达生物、百济神州、君实生物这四小龙;截至目前,只有4款药物成功在美获批上市,含百济神州的泽布替尼、传奇生物的Carvykti、以及近期刚获批的君实生物的特瑞普利单抗和和黄医药的呋喹替尼。
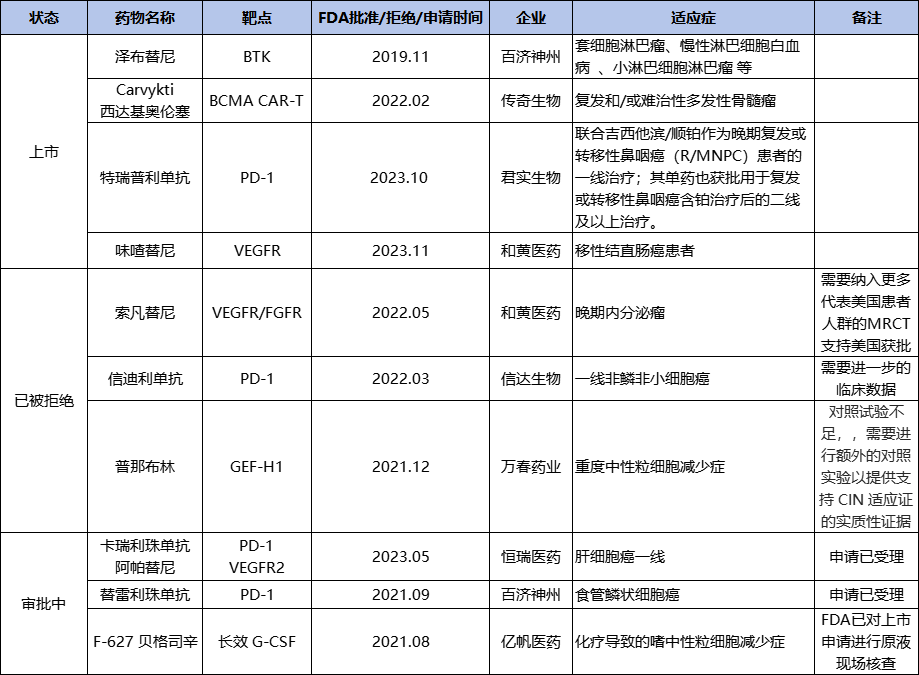
国内创新药闯关FDA情况汇总,
图源:根据公开数据整理
FDA作为全球最权威的药品管理机构,向来铁面无私,截至目前也有3款国产创新药在FDA门前折戟:和黄医药的索凡替尼、信达的信迪利单抗、万春药业的普那布林。
自主出海虽不易,但是一旦成功,由美国市场再向全球市场铺开,带来的利润空间极具想象力,从泽布替尼和Carvykti身上便能知晓。
自获批上市,泽布替尼的市场表现非常亮眼,2022年销售额高达38.29亿元人民币,其中美国市场销售额占了近70%,为26.44亿元。进入2023,泽布替尼依旧销售迅猛,百济神州上半年业绩同比增长30亿元,其中有20多亿来自泽布替尼销售额增长。2023H1泽布替尼全球销售额总计36.12亿元,半年销售额已接近去年全年销售总额,其中美国市场销售依旧占绝大部分,为25.19亿元(上年同期10.15亿元),同比增长150%。
根据百济神州刚刚公布的2023Q3财报,泽布替尼2023 Q3全球销售额3.577亿美元,同比增长130%,不出所料持续高增长。值得注意的是,百济神州的净利润从Q2的-3.81亿美元一下子变成了Q3的+2.51亿美元,一个季度实现6.3亿美元大逆转,实现单季盈利。除了与BMS的仲裁费用3.6亿美元的收入之外,泽布替尼的贡献着实不小。
另外,传奇生物与强生合作的BCMA CAR-T疗法Carvykti 的销售成绩也是一大亮点。Carvykti是2022年2月才在美国获批上市,Carvykti一上市,2022年传奇生物收入1.17亿美元,同比大增70%,均来自于Carvykti在美国商业化销售。2023H1Carvykti的销售额为1.89亿美元,已超过2022全年1.34亿美元的成绩;2023Q3单季更是卖出了1.52亿元,随着季度销售额快速增长,今年Carvykti销售额有望突破5亿美元,明年便可大步走进10亿美元俱乐部,整体也符合强生此前对该药上市后1-2年的销售预期。
事实证明,通过FDA打开全球市场,确实能持续收获“鲜花和掌声”。目前,还有4款国产创新药在FDA门前排队等候入场的号码牌,其中恒瑞医药卡瑞利珠单抗的美国BLA(生物制品许可申请)在今年5月获受理;百济神州替雷利珠单抗的美国BLA(生物制品许可申请)将于2024年下半年由FDA做出决议(今年7月美国FDA已完成对替雷利珠单抗的现场核查)。
根据高特佳投资统计,近两年近30款药物上市申请被FDA拒绝的原因主要归纳为四点: 临床获益不明确,即有效性不足(46%); 安全性数据存疑,即药物毒副作用不耐受(12%); 缺乏国际多区域临床试验(MRCT,15%);药物生产记录及设施存在问题(27%)。
正如和黄医药闯关FDA历程已超十年,且多次受挫。最被熟知的是2020年12月,和黄医药宣布已向FDA滚动提交其自主研发的抗癌药索凡替尼用于治疗胰腺和非胰腺神经内分泌瘤的新药上市申请,但2022年5月,索凡替尼的申请被FDA拒绝,FDA认为需要纳入更多代表美国患者人群的国际多中心临床试验(MRCT)来支持美国获批。
此外,信达生物的信迪利单抗被FDA拒绝的原因也是和索凡替尼如出一辙,FDA建议开展一项信迪利单抗联合化疗vs目前标准疗法一线治疗转移性NSCLC的多区域非劣效性临床试验,并以总生存期为主要终点。
因此对于自主出海的后来者们,国内企业项目立项前期,进行立项调查时应该充分考察开发产品的临床需求,不仅包括中国市场,还应该考察美国甚至全球市场。由于疾病发病有一定的地域性特点,相同疾病在不同地区的发病率不同,药品的临床需求也会不同。例如,肝癌、食道癌在美国是罕见病,但在中国并不是,那么这两种癌症相关的药物在中美市场的临床需求完全不同。
伴随着科技的发展、药物研发技术的进步,药品市场的日趋成熟,美国FDA的法规政策和针对药品的审评体系也在不断变化,国内药企需不断研究其变化,以便制定有利、有效的策略,为自己打造更好的敲门砖。
总之,替雷利珠单抗、特瑞普利单抗及呋喹替尼相继在欧美上市,给了国内其他奋斗在自主出海路上的企业极大的信心,相信会有越来越多的国产创新药走向世界。
参考资料:
1、各公司官网信息,公告,财报数据
2、《恒瑞医药 PD-1 单抗在美申报上市,23 年国产创新药出海有望迎来最新进展》安信证券,2023年5月21日
3、《从百济、传奇、康方们的成功经验看中国创新药出海的机遇与挑战》E药经理人,2023年3月25日


文章评论(0)