罕见病-杜氏肌营养不良:4款小核酸ASO抢滩登陆,多款迭代产品正在路上!
我国DMD患者男性新生儿中的发病率约为1/3500,而有症状的女性携带者估计为1/100000-1/45000。DMD在男性中完全外显,3岁左右步态异常开始变得明显;4-5岁过了平台期之后,运动能力开始倒退;10-12岁丧失独立行走能力,需借助轮椅行动,往往在30岁前因呼吸系统并发症或心力衰竭而死亡。
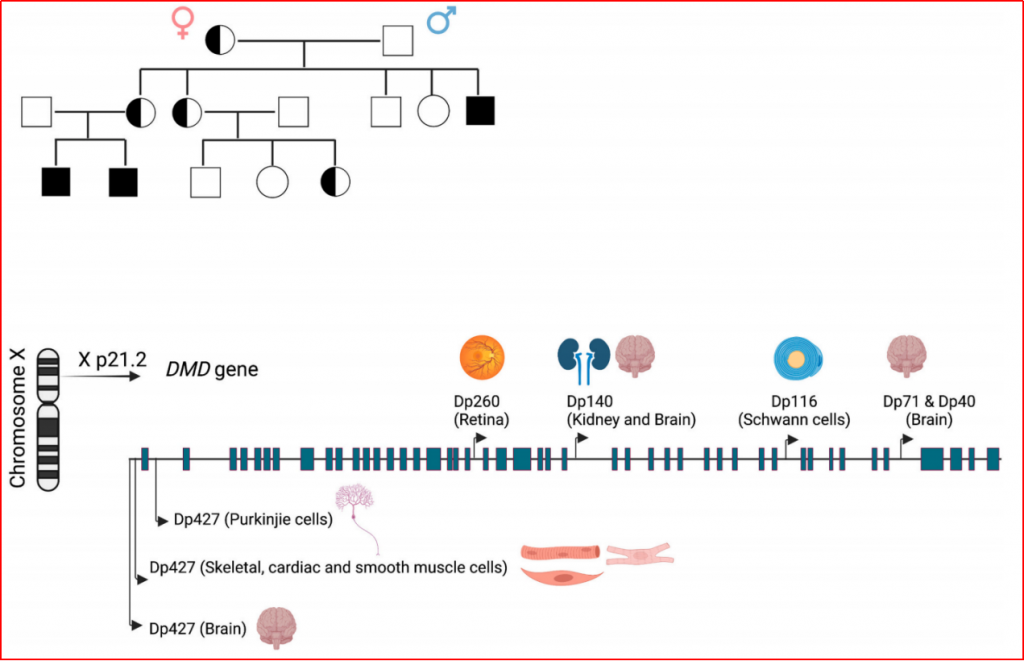
DMD的致病基因为抗肌萎缩蛋白基因,位于染色体Xp21.2区,共包含79个外显子,是已知最大的人类基因。DMD基因的变异以外显子缺失/重复为主。约60.2%为一个或以上外显子的大片段缺失,最常见的缺失区为第45-54和第3-22外显子。
图1-1 DMD基因X连锁隐性遗传
(图片来源:Neurobiology of Disease 168 (2022) 105718. doi.org/10.1016/j.nbd.2022.105718)
传统药物治疗主要采用糖皮质激素,可改善DMD患者的力量和肺功能,减少脊柱手术的需求和延缓心肌病的发生。随着技术的进步,基因替代疗法如AAV技术、更具特点的小分子药物如Ataluren、CRISPR/Cas9技术、以及外显子跳跃药物如部分小核酸ASO药物等,将DMD的治疗推向了更近于治愈的距离。
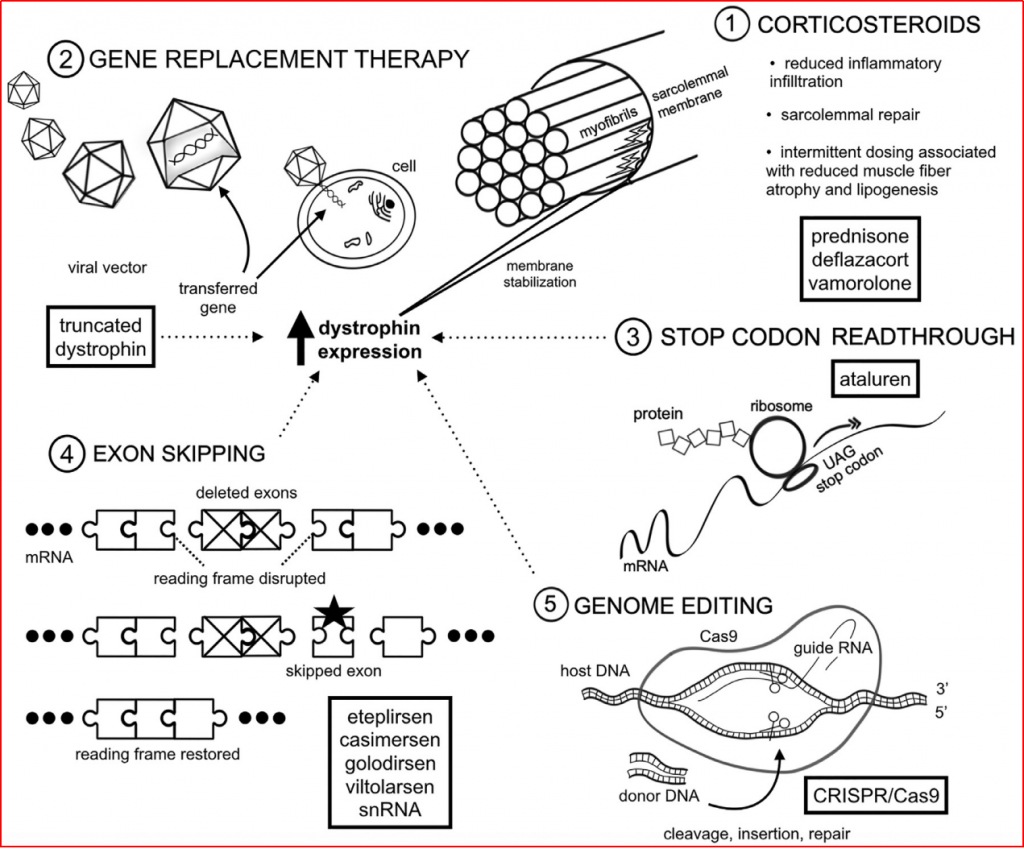
图1-2 DMD现有治疗方法举例
(图片来源:Therapeutic Approaches for Duchenne Muscular Dystrophy: Old and New. doi.org/10.1016/j.spen.2021.100877)
4款小核酸ASO相继获批上市
DMD适应症获批上市的4款小核酸ASO来自于Sarepta Therapeutics和Nippon Shinyaku,其中Sarepta Therapeutics产出了3个药物,Nippon Shinyaku产出1个药物。
■Sarepta Therapeutics
Sarepta Therapeutics开发的3个DMD小核酸ASO,分别为2016年获批上市的Eteplirsen、2019年获批上市的Golodirsen和2021年获批上市的Casimersen,均获得FDA加速审批。
1)Eteplirsen,研发方向为外显子51跳跃。一项纳入含7-16岁患者的Ⅲ期开放标签研究结果显示,治疗后96周时患者的dystrophin水平为基线时的7倍,但绝对水平仍仅为正常水平的0.63%;且部分临床结果表明了Eteplirsen在外显子51跳跃治疗中的长期收益,但其替代终点dystrophin表达量改善效果并不理想。
2)Golodirsen,研发方向为外显子45跳跃。一项Ⅰ/Ⅱ期随机、双盲的安慰剂对照临床试验,研究结果显示,治疗48周时,患者肌肉组织dystrophin水平从正常值的0.095%升高至1.019%。肌肉活检结果表明患者外显子53跳跃率的升高与其dystrophin水平提升呈显著正相关。与外部对照相比,接受Golodirsen治疗第3年的患者在6MWT、延缓行走功能、肺功能障碍方面均显示出了一定的收益。
3)Casimersen,研发方向为外显子53跳跃。一项Ⅰ/Ⅱ期临床试验,结果显示Casimersen不但提高了患者dystrophin水平,还展现了令人满意的药动学结果与安全性。4-30mg·kg–1剂量下每周给药1次,药物大部分(>90%)以原形通过尿液排泄,在体内几乎无蓄积。这可能是目前为止PMOs中安全性最高的药物。
■Nippon Shinyaku
Nippon Shinyaku,在DMD领域的小核酸药物Viltolarsen同样为ASO,于2020年获FDA批准。
Viltolarsen,研发方向为外显子53跳跃。一项Ⅰ/Ⅱ期临床研究结果显示,40mg·kg–1剂量组治疗12周和24周后dystrophin水平分别为正常值的1.21%、1.46%;80mg·kg–1剂量组治疗12周和24周后dystrophin水平分别为正常值的0.76%、4.81%。两剂量组患者的dystrophin水平均有所升高,但仅80mg·kg–1剂量组数据有统计学意义。同一批患者在后续长达192周的长期开放标签治疗中也有显著获益。
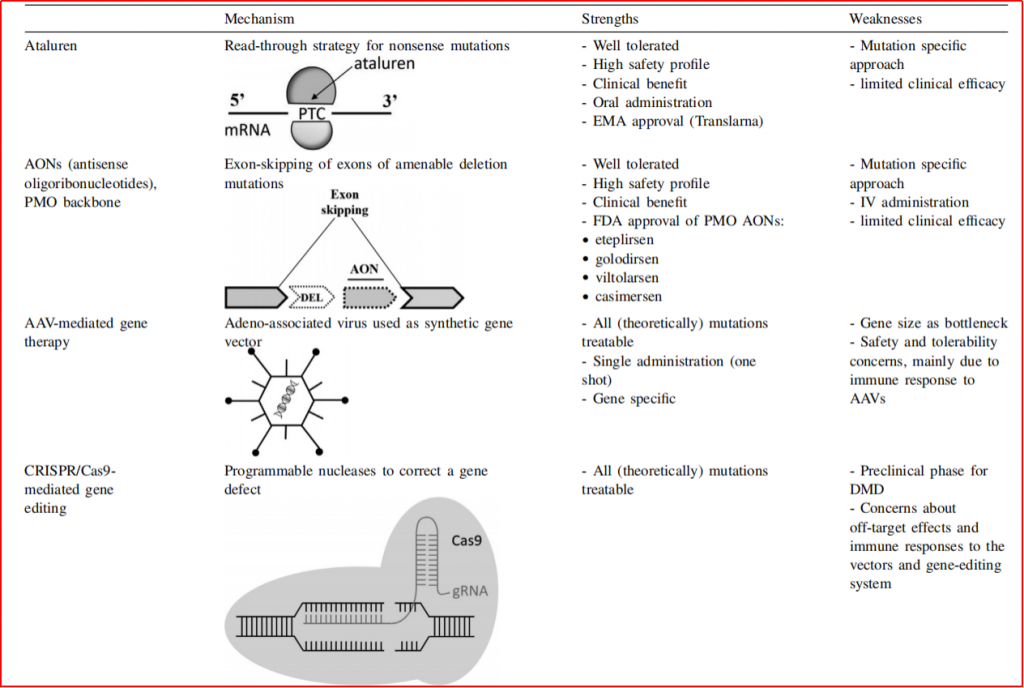
图2-1 ASO药物在恢复dystrophin多种方法中的优劣势
(图片来源:Neuromuscular Disorders 31 (2021) 1013–1020. doi.org/10.1016/j.nmd.2021.08.004)
■Vesleteplirsen(SRP-5051)
研发公司为Sarepta Therapeutics Inc,2024年1月官网发布新闻稿《Sarepta Therapeutics Announces Positive Data from Part B of MOMENTUM, a Phase 2 Study of SRP-5051 in Patients with Duchenne Muscular Dystrophy Amenable to Skipping Exon 51》,阶段结果证实每月给药约30 mg/kg,28周后SRP-5051的平均抗肌萎缩蛋白表达为5.17%,平均外显子跳跃为11.11%,数据支持正性的收益风险分析;受试者年龄为8-21岁(DMD-51外显子)。值得注意的是,SRP-5051使用的PPMO技术,同传统的PMO技术相比,可增加组织渗透性,增强外显子跳跃,并使抗肌萎缩蛋白的产生显著增加。

图3-1 Sarepta-pipeline(部分)
(图片来源:https://www.sarepta.com/products-pipeline/pipeline)
■Brogidirsen(NS-089/NCNP-02)
研发公司为Nippon Shinyaku Co Ltd,该品种已获得美国FDA突破性疗法认定。2023年一项介入性、顺序分配、开放标签、多中心(NCT05996003;NS-089/NCNP-02 -201)计划在美国启动,以评估NS-089/NCNP-02在外显子44跳跃性突变而患有DMD男孩(预计n = 20)中的安全性、有效性、耐受性和药代动力学,试验预计将于2025年9月完成。
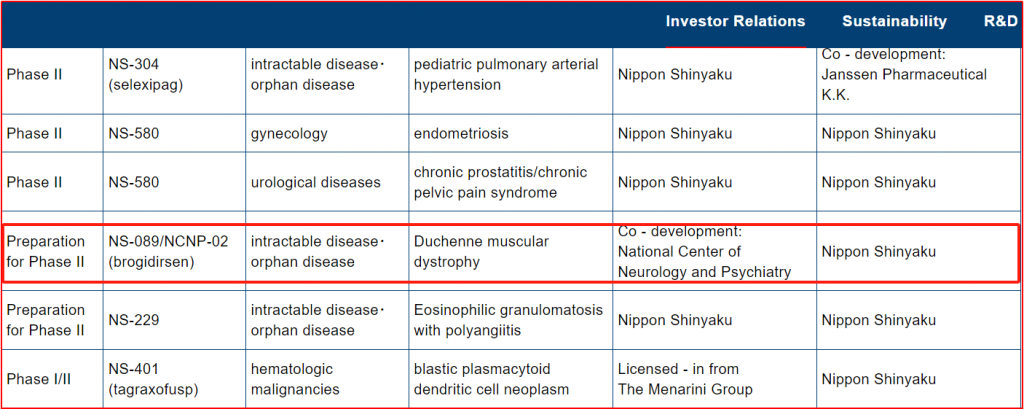
图3-2 Nippon Shinyaku-Product Development(部分)
(图片来源:https://www.nippon-shinyaku.co.jp/english/ir/financial/develop.php)
■PGN-EDO51
研发公司为PepGen,同为一款PPMO技术产品,使用的是公司EDO平台技术,临床直指DMD基因中的外显子51。2024年1月官网发布新闻稿《PepGen Announces First Patient Dosed in CONNECT1-EDO51 Phase 2 Clinical Trial of PGN-EDO51 for Duchenne Muscular Dystrophy Patients Amenable to Exon 51 Skipping》,即CONNECT1-EDO51临床II期试验首例受试者完成入组,而此前,在健康志愿者中进行的单剂量递增PGN-EDO51(5、10,15mg/kg)Ⅰ期临床结果积极,PGN-EDO51在试验中达到主要终点,安全性和耐受性良好。
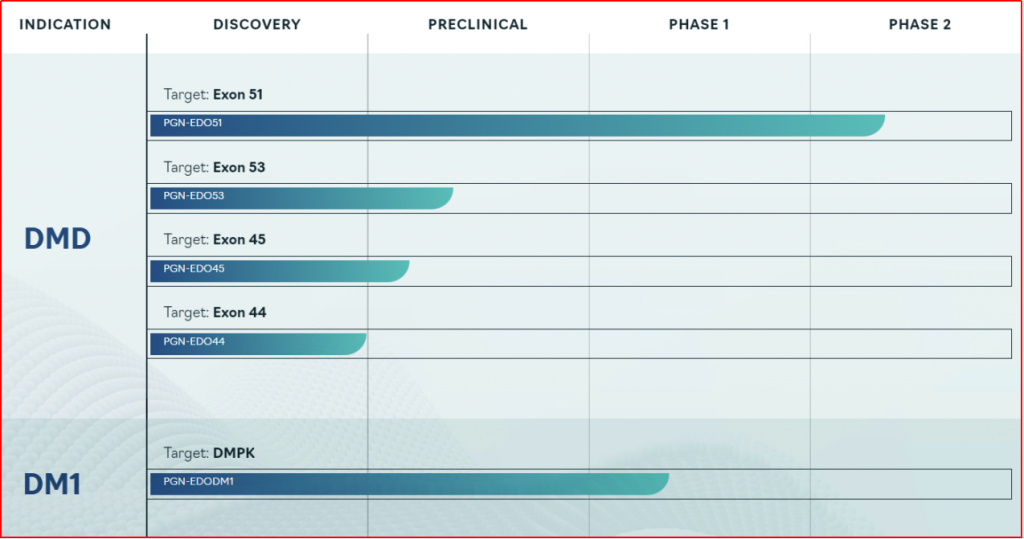
图3-3 PepGen-pipeline
(图片来源:https://www.pepgen.com/pipeline/)
■AOC-1044
研发公司为Avidity Biosciences,是一款AOC药物,由转铁蛋白受体1的单克隆抗体、linker、靶向第44号外显子的治疗性寡核苷酸二磷酸吗啉寡聚物(PMO)等部分构成。2022年10月,一项随机、安慰剂对照、双盲、顺序分配的I/II期研究(EXPLORE44)启动,旨在评估7-27岁健康志愿者(预计n= 40)和DMD突变(外显子44)患者(预计n= 24)单次和多次静脉注射AOC-1044的安全性、耐受性、药代动力学和药效学效应。另,公司官网公开的信息主要为海报《AOC 1044 Mediated Exon 44 Skippingand Restoration of Dystrophin Protein inCynomolgus Monkeys and DMD PatientDerived Myotubes》。
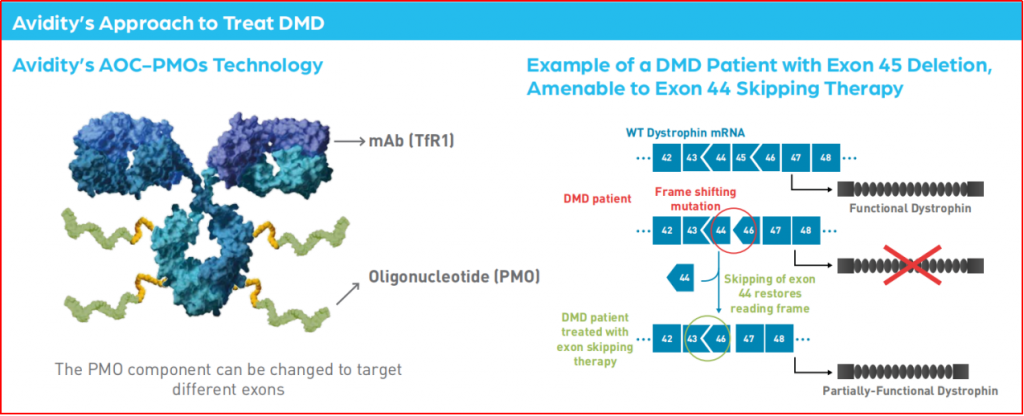
图3-4 AOC 1044作用模式
(图片来源:https://www.aviditybiosciences.com/?s=AOC-1044)
同时,这类药物的研发也并非一帆风顺,如ENTR-601-44在早期临床过程中就遭遇了FDA的叫停。
再者,由于评价方式不同,很多药物并未获得更广泛的监管部门的上市许可。
但,无论是技术特征,还是对尚未满足需求的临床特点,以及广阔的市场价值,小核酸药物的开发还是值得国内一些药企快速跟进的。


文章评论(0)