从FDA一扬一抑看抗生素联合疗法
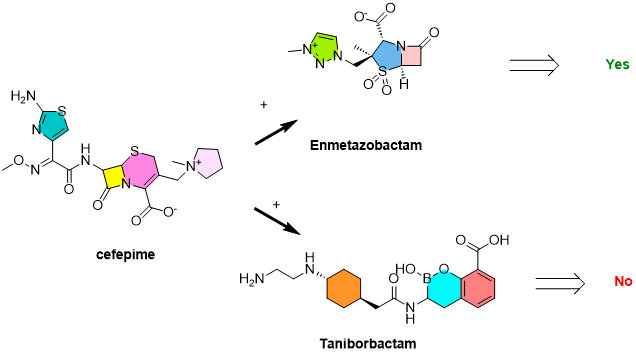
图1. Cefepime,enmetazobactam和taniborbactam化学结构
Enmetazobactam由Orchid Pharma发现,并以此在2013年催化了Allecra Therapeutics的诞生。
Exblifep的批准得到了其3 期试验的背书,该试验显示cefepime和enmetazobactam联合疗法在临床治愈率和微生物根除方面优于护理标准piperacillin/tazobactam(哌拉西林/他唑巴坦),该药用于治疗身体不同部位(例如胃或肠、肺、皮肤、女性生殖器官)的细菌感染。
比较常见的针对抗生素和抗真菌药物的耐药性包括以下几个方面(图2):
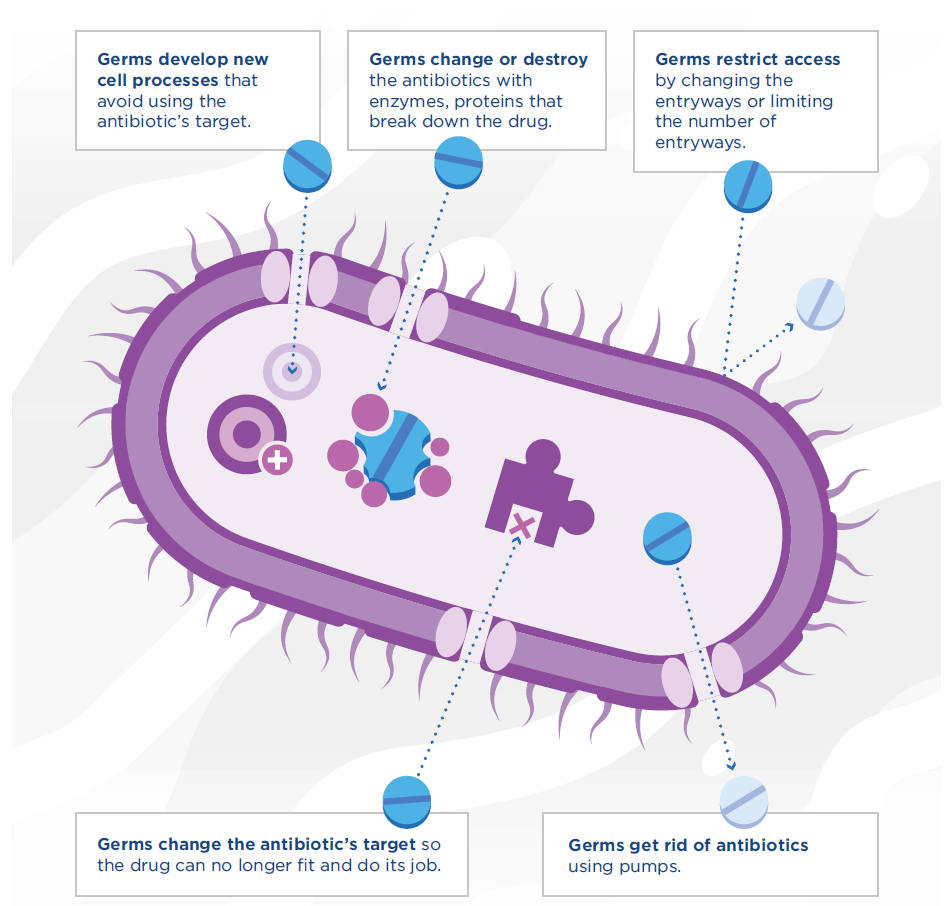
图2. 病菌(细菌与真菌)发展耐药性的机制示意图
(图片来源:CDC)
- 限制抗生素的进入:细菌通过改变入口通道或限制入口通道的数量来限制抗生素药物的进入。比如革兰氏阴性细菌有一个脂质外膜,可以保护细菌免受环境的影响。这些细菌可以利用这种膜选择性地阻止抗生素药物分子的进入。
- 摆脱抗生素或抗真菌:细菌可以利用细胞壁中的外泌胞泵去除那些已经进入细胞的抗生素药物,从而摆脱抗生素。这些泵可以将物质从细胞内部排出到细胞外部,从而帮助细菌适应环境压力。例如一些铜绿假单胞菌细菌可以用外泌胞泵来清除几种重要抗生素药物,包括氟喹诺酮类、β-内酰胺类、氯霉素和甲氧苄啶。一些念珠菌产生的泵可以清除氟康唑等唑类药物。
- 改变或破坏抗生素:细菌可以利用酶和其它蛋白来改变或破坏抗生素药物分子。例如肺炎克雷伯氏菌产生碳青霉烯酶(carbapenemases),它们可以分解碳青霉烯类的抗生素药物和大多数其它β-内酰胺类抗生素药物。
- 改变抗生素靶标:许多抗生素药物精确瞄准细菌的特定部分(靶标)。但细菌可以改变抗生素的靶点,使药物不再发挥作用。例如:带有 mcr-1 基因的大肠杆菌可以在细胞壁外部添加一种化合物,使粘菌素药物无法附着在其上。又如烟曲霉可以改变 cyp1A 基因,使三唑类药物无法与其靶标蛋白质结合。
- 绕过抗生素的作用:细菌会开发出新的细胞过程,可以避免产生抗生素针对的靶点,以此方式躲避抗生素的摧毁作用。例如一些金黄色葡萄球菌可以绕过甲氧苄啶的药物作用。
这种协同作用有些类似于Covid-19药物Paxlovid的原理。Paxlovid由两个成分nirmatrelvir和ritonavir组成。真正的活性物质是拟肽 nirmatrelvir,是它以蛋白酶抑制剂的身份阻断病毒繁殖所需的蛋白酶活性。
联合抗菌治疗并不是一个新概念。结核分枝杆菌 (TB) 是已知最古老的细菌感染之一,也是世界上最致命的传染病杀手之一,必须使用多种药物进行治疗,防止治疗期间出现耐药性。然而结核杆菌的耐药性不可避免地在治疗过程中产生,因此使用单一抗生素将很快面临山穷水尽的局面。考虑到单个杆菌同时对多种药物产生耐药性的可能性非常低,因此临床医生通常会求助于联合疗法,以防止单一药物出现耐药性问题。联合治疗除了防止耐药性的出现之外,还具有潜在的优势。例如,第二种药物可以增强第一种药物的活性。
不同的抗生素针对细菌内部不同的细胞结构或过程起效。它们可以协同作用,也就是说,它们的组合活性比每种药物单独的作用更有效,从而产生1+1>2的效果。当然它们也可以相互拮抗,在这种情况下,一种药物的存在会阻碍另一种药物的活性。但这种拮抗作用也可以“铸剑为犁”地被应用于减轻抗生素对患者肠道微生物群的附带损害。
除了使用多种抗生素的疗法对抗病菌耐药性之外,噬菌体与抗生素的联合疗法也逐渐成为人们的武器。噬菌体(Bacteriophage,被简称为Phage)是一种以细菌为目标并感染细菌的病毒,在细菌复制时杀死它们。不同的噬菌体针对不同的细菌,并且具有很强的选择性,因此它们只针对特定的细菌菌株,而不会感染其他细菌或损伤人体细胞。噬菌体数量丰富,从水、土壤到人体随处可见。污水处理厂的废水是研究人员用来分离新噬菌体的常见来源。噬菌体攻击细菌的方式与抗生素不同,噬菌体疗法与抗生素协同作用可以帮助患者抵抗感染。但目前尚未有经FDA审批上市的噬菌体药物,与抗生素的联合疗法也存在争议。

图3. Sulbactam和durlobactam化学结构
辉瑞的管线里也存在抗生素组合资产氨曲南-阿维巴坦(ATM-AVI, aztreonam-avibactam,图4)。其3期研究结果表明,这种新型药物对于治疗革兰氏阴性菌引起的严重细菌感染具有良好的有效性、安全性和耐受性。Aztreonam-avibactam针对多重耐药性病原体,它们通过生成Metallo-β-lactamases (MBLs) 内酰胺酶的方式产生耐药性,这些病原体的治疗选择非常有限。
ATM-AVI结合了aztreonam(一种单菌素 β-内酰胺)和avibactam(一种最新的广谱 β-内酰胺酶抑制剂)。MBLs是一类 β-内酰胺酶,不受当前大多数β-内酰胺酶抑制剂的控制,可水解几乎所有 β-内酰胺类抗生素,但像aztreonam这样的单菌酰胺类抗生素除外。尽管如此, 然而,与MBL共同产生的其他 β-内酰胺酶则有可能降解aztreonam,因此限定了后者作为单一疗法的临床用途。在这种情况下,内酰胺酶抑制剂的avibactam的协同作用就被凸显出来。
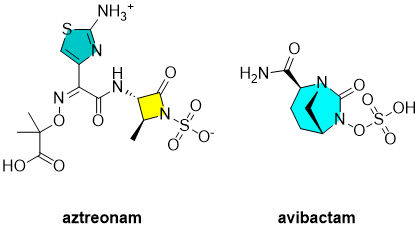
图4. Aztreonam-avibactam化学结构
Aztreonam与avibactam阿维巴坦的联合疗法可增强氨曲南的抗菌活性,如果获得批准,可以为针对多重耐药革兰氏阴性菌提供急需的安全有效的治疗选择。
最后要说的是,文章一开始提到的Venatorx Pharmaceuticals 和 Melinta Therapeutics 针对复杂性尿路感染的抗生素组合疗法头cefepime/taniborbactam,尽管收到了FDA的完整回复函(CRL),但FDA针对的并不是药物的安全性或有效性,而是制造过程的问题。同辉瑞3期的管线资产aztreonam-avibactam组合(图4)类似,cefepime/taniborbactam也是内酰胺抗生素和metallo-β-lactamases酶抑制剂的协同。相信在解决了相关的制造问题之后,这款抗生素联合疗法同样能够获得FDA的最终通过,增加人类对抗耐药性细菌感染的武器。
参考:
Dunleavy, K. One Up, One Down: Allecra scores FDA nod for antibiotic combo after Venatorx hit with rejection. Fierce Pharma. 27. 02. 2024.
How Antimicrobial Resistance Happens. Centers for Disease Control and Prevention. Retrieved on 28. 02. 2024.
Brennan-Krohn, T. Combination Antibiotic Testing: When 2 Drugs are Better than 1 (or 2). American Society for Microbiology. 01. 09. 2018.
Ramsey, L. Researchers profile new drug combinations to fight antibiotic-resistant bacteria. 19. 10. 2023.
Hydzik, A. Case Study: Drug-Resistant Bacteria Responds to Phage-Antibiotic Combo Therapy. UPMC. 14. 02. 2024.
Phase 3 Studies of Pfizer’s Novel Antibiotic Combination Offer New Treatment Hope for Patients with Multidrug-Resistant Infections and Limited Treatment Options. Pfizer Press Release. 01. 06. 2023.


文章评论(0)