突破肿瘤适应症,小核酸药物已箭在弦上!
2022年中国新发恶性肿瘤病例约482.47万例;其中,男性新发病例253.39万例,女性新发病例229.08万例;人群恶性肿瘤的粗发病率是341.75/10万,其中男性(351.44/10万)高于女性(331.64/10万)。发病率最高的10大癌症依次为肺癌、结直肠癌、甲状腺癌、肝癌、胃癌、乳腺癌、食管癌、宫颈癌、前列腺癌和子宫体癌,约占全部新发病例的78%。
2022年全国恶性肿瘤死亡病例约257.42万例;其中,男性162.93万例,女性94.49万例。死亡病例数最高的10大癌症依次为肺癌、肝癌、胃癌、结直肠癌、食管癌、胰腺癌、乳腺癌、宫颈癌、前列腺癌和卵巢癌,约占全部恶性肿瘤死亡的80%。
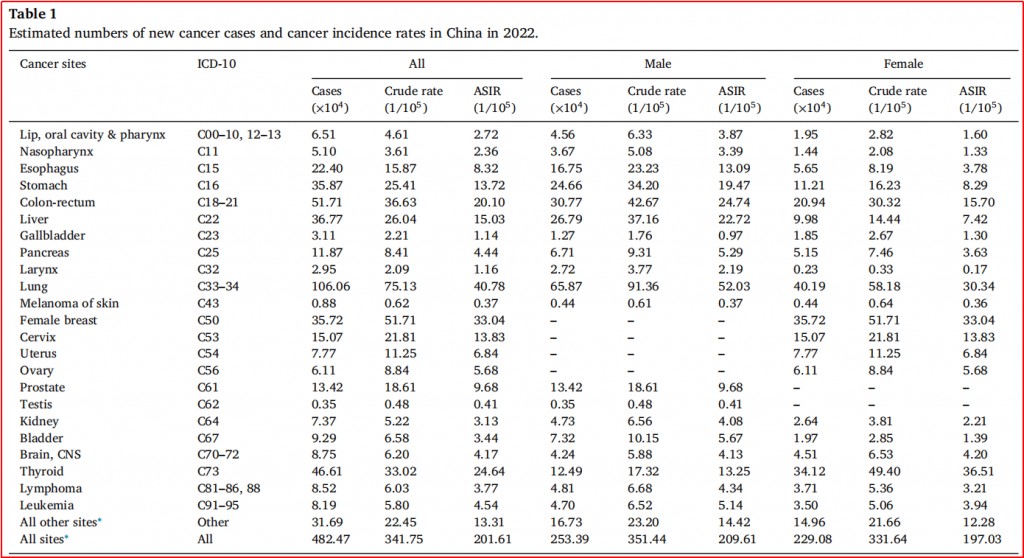
图1-1 中国2022年新增癌症病例数和癌症发病率
(图片源:doi.org/10.1016/j.jncc.2024.01.006)
Fomivirsen是第1个被FDA批准用于疾病治疗的反义寡核苷酸药物,通过与人类巨细胞病毒中的关键基因的序列互补结合,用于治疗艾滋病病人中巨细胞病毒性视网膜炎。该药于1998年获FDA批准上市,后来由于其他同类药物的竞争,最终分别于2002年及2006年退出欧洲及美国市场。
截至2023年,全球获批上市的小核酸药物共计约19款,适应症主要为遗传相关疾病、罕见病、肝脏相关疾病,尚无肿瘤相关适应症获批。
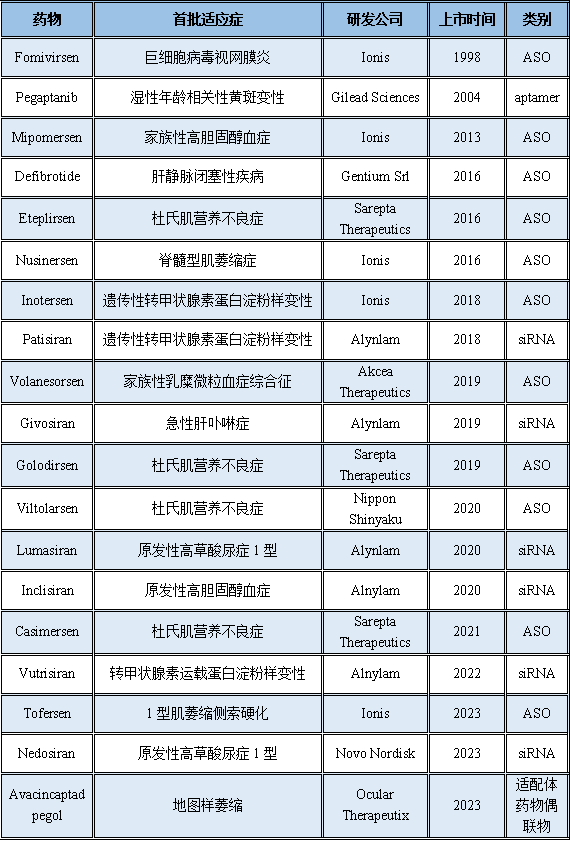
表2-1 全球上市的小核酸药物(不完全统计)
(信息源:https://synapse.zhihuiya.com/report)
通过小核酸技术调控肿瘤细胞关键基因的表达,进而干预肿瘤的正常代谢和细胞生命活动,引起肿瘤细胞凋亡,抑制肿瘤细胞生长,这是极具应用前景的肿瘤治疗方式,既能够进行多基因共同干预,也能同传统治疗方式联合使用。当前,已有部分产品进入到临床阶段,距离肿瘤适应症的突破,已箭在弦上。
靶点方面,ASO类产品聚焦的靶点更为丰富,数量也更多,如Akt、IGF-1R、STAT3、AR、Hsp27、Bcl-2、TGF-β、PD-1等,都有ASO产品布局;而聚焦于肿瘤领域的siRNA产品,首先从数量来说就略少于ASO,靶点主要有KRAS G12D、TGF-β、HIF-2α、Bcl-2等。下面以寡头Ionis公司相关产品、靶点(STAT3、AR、YAP1、IRF4)进行举例介绍。
➣ Danvatirsen
Danvatirsen,其他研发代号还有AZD-9150,是一款ASO,靶向STAT3,该品种开展的肿瘤领域适应症包括非小细胞肺癌、晚期结直肠癌、胰腺癌、头颈部鳞状细胞癌、弥漫性大B细胞淋巴癌、晚期肝细胞癌、急髓白血病等,临床最高阶段为II期。2021年9月,Flamingo Therapeutics宣布与Ionis Pharmaceuticals公司达成协议,共同开发RNA靶向疗法,以治疗各种形式的癌症,Danvatirsen就是合作开发的3个项目之一。
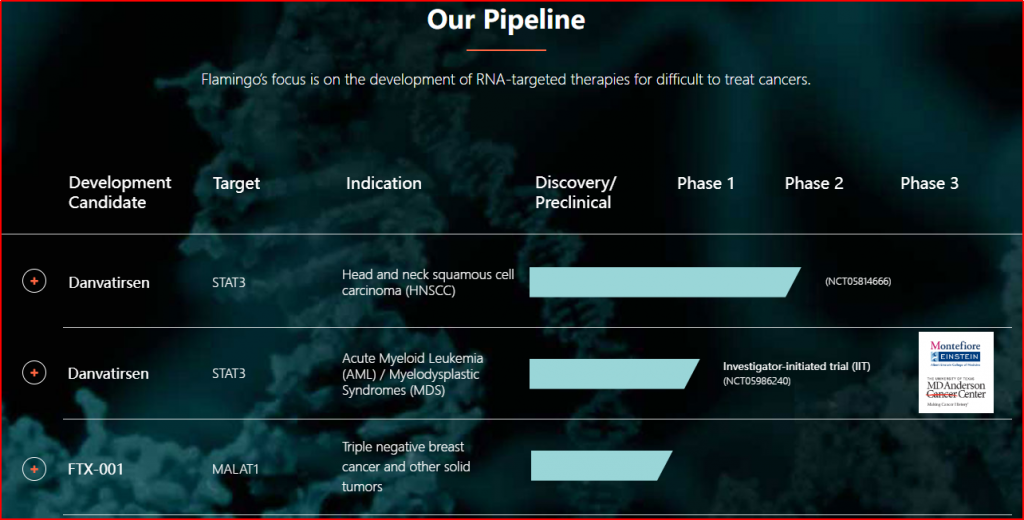
图3-1 Flamingo Therapeutics公司管线
(图片源:https://flamingotx.com/clinical-programs/#pipeline)
➣ AZD-5312
AZD-5312,其他研发代号还有IONIS-ARRx/ISIS-560131,是一款ASO,靶向AR,该品种开展的肿瘤领域适应症主要为去势抵抗性前列腺癌,最高阶段为临床II期。该品种于我国开展的临床试验为“评价ISIS 560131在雄激素受体剪接变异体7(AR-V7)阳性的转移性去势抵抗性前列腺癌患者中的安全性、疗效和药代动力学的IIa期临床研究”,但在中国的试验状态为“主动终止”。
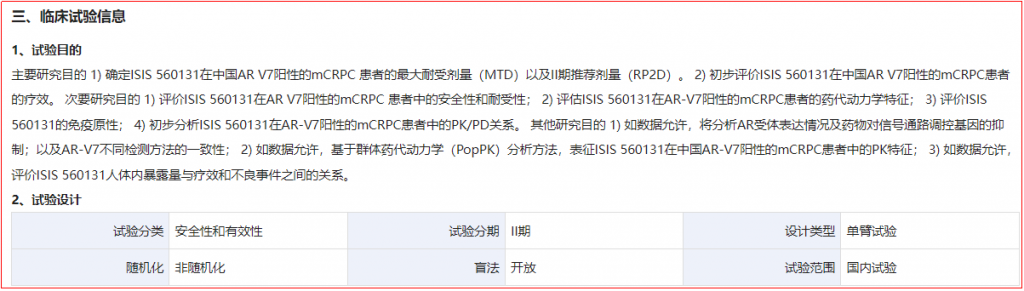
图3-2 ISIS-560131国内临床试验部分信息
(图片源:http://www.chinadrugtrials.org.cn/index.html)
➣ ION-537
ION-537,是针对因子YAP1(Hippo通路)设计的ASO,该靶点初步确认在某些肝细胞癌和头颈癌中至关重要,研发公司Ionis Pharmaceuticals的合作伙伴为德克萨斯大学MD安德森癌症中心,临床适应症为晚期实体瘤,处于临床I期。该品种进入临床,也为Hippo通路产品的产出提供了思路。

图3-3 ION-537临床I期试验部分内容(NCT04659096)
(图片源:https://clinicaltrials.gov/study/NCT04659096?cond=ION-537&rank=1)
➣ Frenlosirsen
Frenlosirsen,其他研发代号还有ION251,该品种的靶点为IRF4(干扰素调控因子4),同为一款ASO,在研适应症为复发难治性多发性骨髓瘤,当前处于临床I期。NCT题目为“A Study of ION251 Administered to Patients With Relapsed/Refractory Multiple Myeloma”。另,IRF4是参与正常B细胞和T细胞中免疫反应的转录因子,并且强烈涉及血液恶性肿瘤,尤其是多发性骨髓瘤,高IRF4水平与MM患者的总体存活的不良预后相关联。当前,靶点IRF4临床在研品种非常少,适应症主要指向血液瘤。
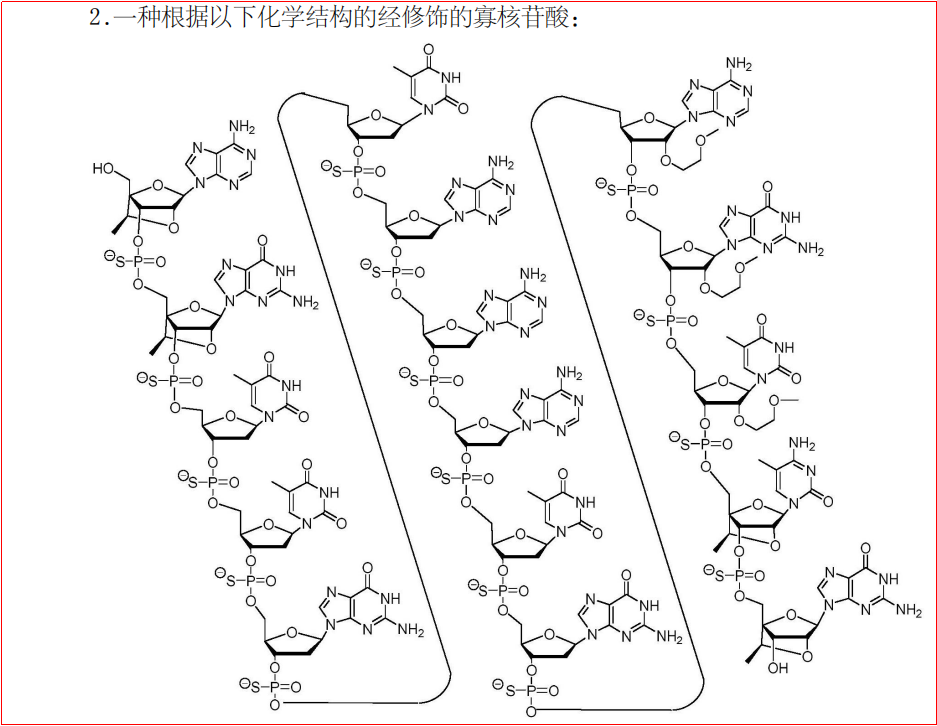
图3-4 专利CN 111886011 B权2内容
(图片源:CN 111886011 B)
➣ HC0301
据官网介绍,HC0301是海昶当下的主要产品,该产品源自海昶生物自主研发的QTsomeTM核酸递送技术,可将反义寡核苷酸Archexin包裹在脂质纳米颗粒内,进而研发出新型AKT-1抑制剂HC0301。HC0301针对晚期实体肿瘤的I期剂量递增临床试验(NCT05267899)数据表明,HC0301的安全性良好。
2024年,HC0301计划布局四个治疗领域,晚期肝癌和肾癌是产品的首发疾病领域。其中,HC0301针对晚期肝癌的临床试验已获FDA临床II期试验默许,并获得孤儿药资格认证。HC0301在肾癌疾病领域主要针对透明细胞肾癌二线和非透明细胞肾癌的一线治疗。
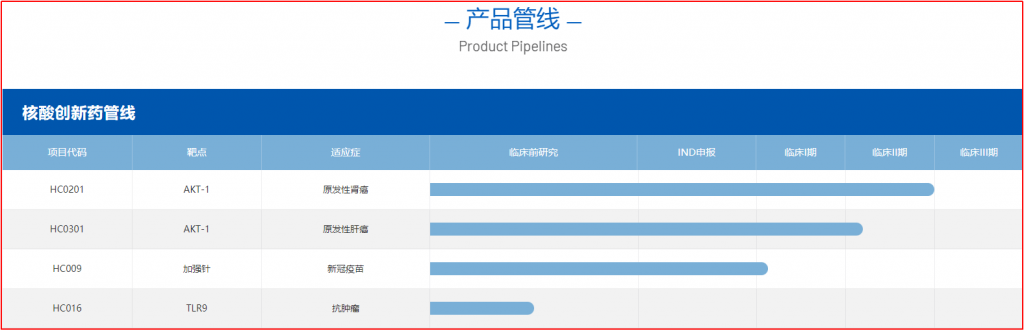
图4-1 海昶生物相关管线
(图片源:http://www.zhejianghaichang.com/product_zh.html)
➣ CT102
据官网介绍,注射用CT102是我国首个自主研发的反义核酸药物,是长度为20个核苷酸的硫代脱氧寡核苷酸钠盐,通过反义作用机制,抑制IGF1R靶标的表达,发挥抑制肿瘤的作用。2021年3月,悦康药业启动该项目Ⅰ期临床试验,并于2022年1月完成了Ⅰ期临床试验。Ⅰ期临床试验表明,注射用CT102未发生导致药物停用或受试者退出的不良反应或AE,未发生致命的不良反应或AE,表现出良好的安全性和耐受性。2022年3月,Ⅱa期项目启动会启动,且最终试验题目为“评价注射用CT102治疗原发性肝癌的安全性、有效性和药物代谢动力学的非随机、开放性Ⅱa期临床试验”。
图4-2 CT102国内II期临床试验部分信息
(图片源:http://www.chinadrugtrials.org.cn/clinicaltrials.searchlistdetail.dhtml)
1. Cancer incidence and mortality in China, 2022. doi.org/10.1016/j.jncc.2024.01.006
2. 小核酸药物研发进展及技术平台调研. https://synapse.zhihuiya.com/report
3. 反义寡核苷酸药物在精准治疗中的应用进展及其作用机制. 2020. CNKI
4. https://finance.sina.com.cn/stock/med/2023-08-19/doc-imzhsuai6481179.shtml
5. https://www.vbdata.cn/newsDetail/e2a54af5c9fd4725335b6b14148018c1
6. 专利CN 111886011 B
7. https://clinicaltrials.gov/
8. http://www.zhejianghaichang.com/news_detail_zh/id/56.html
9. https://www.youcareyk.com/content/details23_266841.html
10. 其他网络公开信息


文章评论(0)