PDC,是弥补ADC不足,还是别有一番天地?
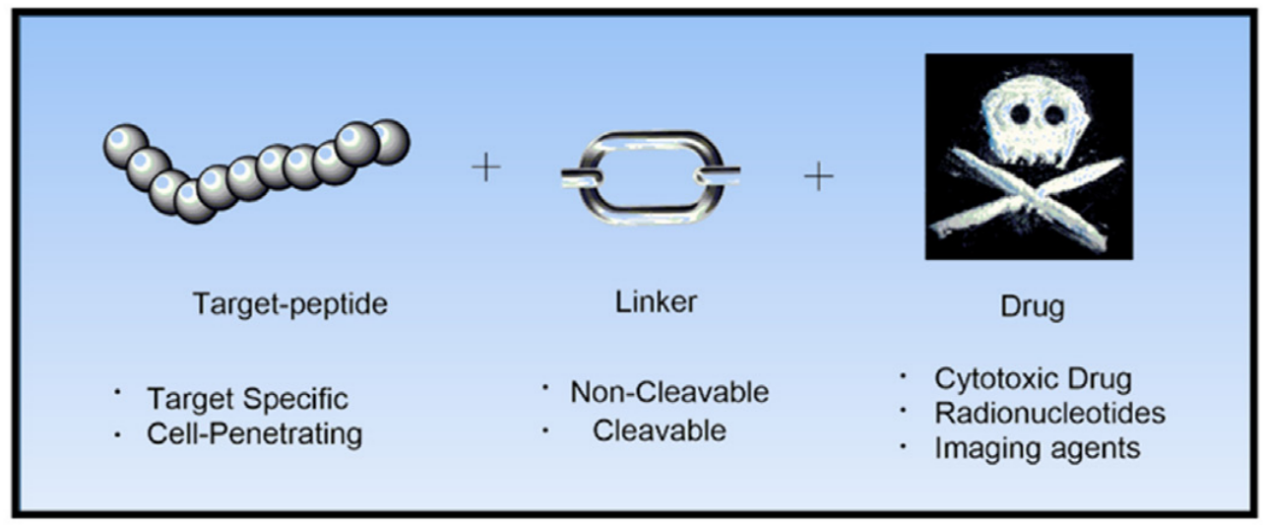
图1-1 PDC-结构组成
(图片源:doi.org/10.1016/j.apsb.2022.07.020)
以肿瘤领域为例,相较于抗体大分子,靶向肽与毒素分子结合的优势主要体现在以下方面:1)分子体积小(2-20 kDa),更容易穿透肿瘤基质,进入肿瘤细胞;2)可化学合成,生产过程简便且易于规模放大;3)可与阿霉素、紫杉醇多种已获临床验证的细胞毒性分子偶联制备靶向制剂,无须局限于ADC领域中MMAE、DM-1等极少数高毒结构,显著降低脱靶毒性影响,可极大地提高PDC制剂平台技术的可行性;4)部分靶向肽可通过改变入胞机制克服肿瘤细胞的耐药性,实现耐药肿瘤的有效杀伤,打破传统化疗中普遍存在的耐药导致治疗无效的困境。

图1-2 ADC和PDC之间的对比
(图片源:doi.org/10.1016/j.apsb.2022.07.020)
同ADC比较,PDC最大的不同之处首当其冲为“P”~肽。基于多肽类药物长期的发展,以及显著的成功,整个行业对于肽的研究积累已经很多。同样以肿瘤领域为例,PDC结构中使用的肽主要有肿瘤细胞靶向肽、肿瘤血管靶向肽、细胞器靶向肽、细胞穿膜肽、肿瘤微环境敏感肽、治疗肽等,具体特点见下表。
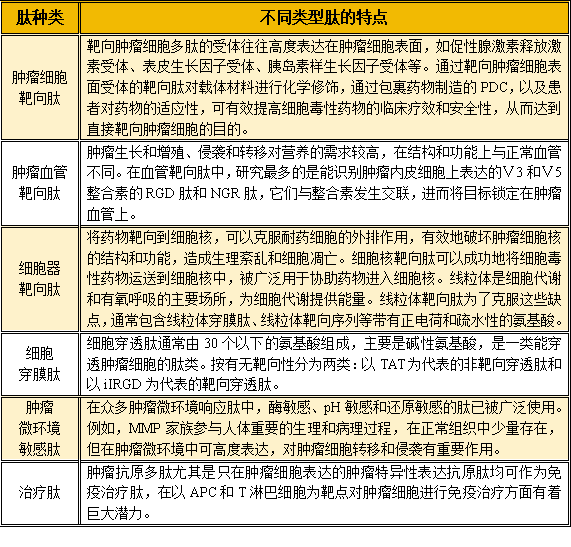
表1-1 肿瘤领域PDC结构中肽的特点
➣ Lutathera ([177Lu] Lu-DOTATATE)
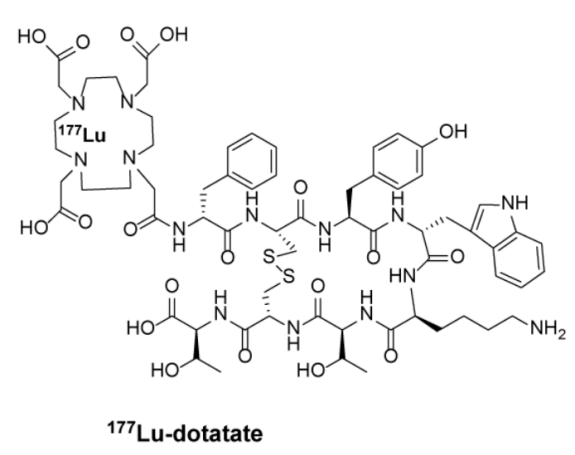
Lutathera ([177Lu] Lu-DOTATATE),由诺华子公司Advanced Accelerator Applications SA开发(2017年诺华以39亿美元收购了Advanced Accelerator Applications),于2018年1月获FDA批准上市,获批适应症为SSTR阳性胃肠胰神经内分泌肿瘤,中国最高研发阶段为临床III期。
该PDC由放疗药物l77Lu通过高亲和力结合剂1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)与奥曲肽螯合,在与表达生长抑素受体的细胞(包括生长抑素受体表达阳性的恶性肿瘤)结合后被内化,来自177Lu的β射线通过在细胞及邻近细胞中形成自由基而诱导细胞损伤,用于治疗生长抑素受体阳性的胃肠胰腺神经内分泌肿瘤。这是放疗药物首次被批准用于治疗神经内分泌肿瘤,也是PDC领域上市较早的一款治疗药物。据年报披露,2023年Lutathera实现了6.05亿美元的营收。
图2-1 Lutathera([177Lu] Lu-DOTATATE)产品信息
(图片源:Strait Pharmaceutical Journal(2023)& https://www.adacap.com)
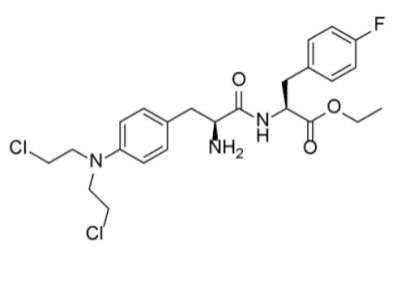
➣ Pepaxto(Melflufen)
Pepaxto(Melflufen),开发公司为Oncopeptipes,该药物于2021年2月被FDA批准加速上市,适应症为联合地塞米松用于治疗已接受至少四项前期疗法,并且疾病对至少一种蛋白酶体抑制剂、免疫调节剂、和靶向CD38的单克隆抗体产生耐药性的复发/难治性多发性骨髓瘤成年患者。2021年10月,Oncopeptipes宣布Pepaxto从美国市场撤回,原因主要为Pepaxto在验证性III期OCEAN研究中未能降低ITT人群的死亡风险。2024年2月,美国FDA发布最终决定撤销Oncopeptides公司Pepaxto(美法仑氟苯酰胺)的加速批准。
Pepaxto这款产品是开发公司专有肽-药物偶联物平台开发的一种首创的、靶向氨肽酶的PDC,能迅速将DNA烷化剂melphalan(美法仑)有效荷载传递到肿瘤细胞中。由于高亲脂性,melflufen能被骨髓瘤细胞迅速吸收。一旦进入细胞内,melflufen的偶联肽会立即被氨肽酶裂解,释放出亲水性烷化剂有效荷载美法仑,并被截留在细胞内。体外试验中,由于其胞内截留的烷化剂美法仑浓度的增加,melflufen在骨髓瘤细胞中的效力比美法仑强50倍,可迅速诱导骨髓瘤细胞发生不可逆的DNA损伤,导致细胞凋亡。
图2-2 Pepaxto(Melflufen)产品信息
(图片源:Strait Pharmaceutical Journal(2023)& https://www.fda.gov/drugs)
ANG1005,是AngioChem开发的PDC药物,已进入III期临床试验,该品种已同国内盛诺基医药共同开发。据官网介绍,该品种是由紫杉醇分子与化学合成的氨基酸多肽结合形成的偶联物,是国内首个能将紫杉醇特异性递送至脑部的1类新药。在已完成的2项乳腺癌脑转移II期临床试验表明:该品种具有明确的乳腺癌脑转移肿瘤及颅外肿瘤的临床治疗效果,安全性与普通紫杉醇类似且无严重过敏反应。
Zoptarelin doxorubicin(AEZS-108),是Aeterna Zeataris公司开发的一款PDC,是由D-Lys6-GnRH作为靶标特异性配体,戊二酸作为连接臂,ADM作为细胞杀伤分子设计得到,对GnRH受体阳性的肿瘤细胞具有高度亲和力。在乳腺癌细胞株MCF-7和MDA-MB-231上,AEZS-108与GnRH受体结合的EC50值约为2-13nM。研究表明,AEZS-108对过表达GnRH受体的卵巢癌、乳腺癌、子宫内膜癌等具有良好的治疗作用,活性强于ADM,且毒副作用较小。但,由于AEZS-108无法提高晚期子宫内膜癌患者的中位生存期,其III期临床试验已被终止。
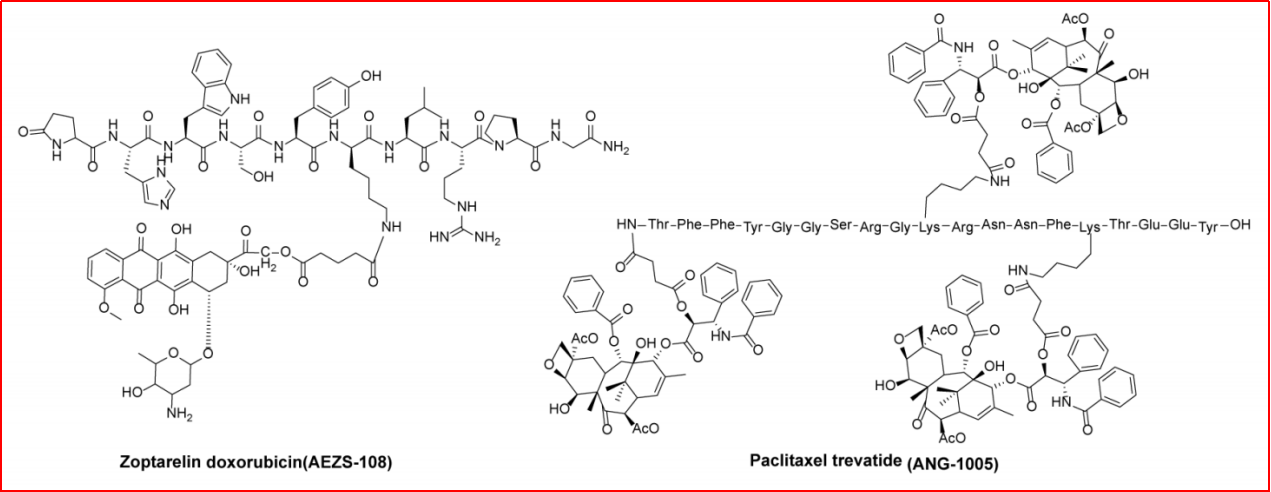
图3-1 ANG1005和Zoptarelin doxorubicin结构特点
(图片源:Strait Pharmaceutical Journal(2023))
CBP-1008,是同宜医药基于第一代bi-XDC技术平台开发的双配体偶联药物,该品种由优化的特异性靶向FOLR1/TRPV6的双配体连接子系统,可酶裂解的三功能连接子,以及作为载药的细胞毒素MMAE组成。CBP-1008在临床前实验中展现了显著的双配体协同效应。它能克服内源性配体带来的竞争。临床前的CDX和PDX模型药效试验中也有体现,受体表达和疗效之间有较强的相关性。I期已基本完成安全性和耐受性的探索,尚未达到MTD;II期单臂研究为既往1-3线系统抗肿瘤治疗的FRα阳性,铂耐药晚期上皮性卵巢癌、原发性腹膜癌和输卵管癌,2023年2月已正式启动患者入组;在复发或持续性铂耐药卵巢癌、原发性腹膜癌和输卵管癌透明细胞亚型患者中的疗效和安全性的开放标签、国际多中心II期单臂研究也在同步进行中。
BT-1718,是原研公司Bicycle Therapeutics开发的一款PDC,目前处于临床II期,临床适应症指向乳腺癌、非小细胞肺癌等实体瘤,结构上BT-1718由特定的双环肽组成,该双环肽可裂解的二硫键与DM1细胞毒素偶联。临床试验NCT03486730结果证实,在现有给药剂量水平下该品种具有良好的耐受性。
BGC0228,是博瑞生物开发的一款长效多肽靶向偶联药物,据2023年第三季度年报信息显示,注射用BGC0228处于临床Ⅰ期试验阶段,目前正在 125mg/m²剂量水平开展剂量扩展研究,扩展瘤种包括宫颈癌、卵巢癌和胃食管癌等,已完成13例受试者入组给药。

图3-2 全球PDC部分产品相关信息
(图片源:doi.org/10.1016/j.apsb.2022.07.020)
参考:
1. Acta Pharmaceutica Sinica B. doi.org/10.1016/j.apsb.2022.07.020
2. 中国医药工业杂志 Chinese Journal of Pharmaceuticals 2021,52(5).
3. https://www.adacap.com/
4. https://www.fda.gov/drugs/resources-information-approved-drugs/withdrawn-fda-grants-accelerated-approval-melphalan-flufenamide-relapsed-or-refractory-multiple
5. doi.org/10.1016/j.apsb.2022.07.020
6. SHANDONG CHEMICAL INDUSTRY. 2023(52)
7. The Chinese Journal of Process Engineering. 2021
8. 诺华2023财报
9. http://shenogen.com/newsdetail.aspx?NewsId=138&cateid=24
10. https://www.coherentbio.com/#/home
11. https://static.sse.com.cn/disclosure/listedinfo/announcement/c/new/2023-10-27/688166_20231027_DC0C.pdf
12. Strait Pharmaceutical Journal Vol.35 No.6 2023



文章评论(0)