神州细胞成立于2002年,2020年6月登陆科创板。神州细胞致力于研发具备差异化竞争优势生物药的创新型生物制药研发公司,专注于恶性肿瘤、自身免疫性疾病、感染性疾病和遗传病等多个治疗和预防领域的生物药产品研发和产业化。目前神州细胞有2款创新药获批上市(其中,2021年7月,历时14年,神州细胞自主研发的首个产品安佳因®(重组人凝血因子 VIII)获批上市,成为10亿大单品)、2个疫苗产品被国家纳入紧急使用,2个生物类似药单抗品种处在上市审评阶段,另有多个品种处于临床研究中后期阶段。
自2020年登陆科创板以来,神州细胞市值最高曾一度高达400多亿元。另外从2021年首款产品上市以来,营收便呈现爆发式增长,2021年、2022年分别增长408.5倍及6.61倍,2023年度实现营业收入18.87亿元,同比增长84.46%。研发投入方面,2020年-2023年前三季度,研发费用分别达到6.1亿元、7.3亿元、8.9亿元及8.1亿元。但另一方面由于大手笔研发投入,神州细胞连年陷入亏损。不过在一款大单品安佳因持续输血,其他多款药物加持的情况下,神州细胞的未来发展将愈发明朗及稳定。
年营收近20亿大单品安佳因首款国产重组凝血因子VIII
安佳因2021年7月获批上市,是我国首个获批上市的国产重组凝血八因子产品,用于治疗罕见病甲型血友病(2023年新增了12岁以下儿童适应症),也是神州细胞的首个商业化产品。安佳因填补了国产重组凝血八因子的空白,在其未上市之前,拜耳、百特、辉瑞等外资企业的五款同类产品长期垄断中国市场,不仅价格昂贵,且供应不足。通过改进工艺,神州细胞将重组凝血八因子年设计产能提高到100亿国际单位(IU),产量接近全球数十厂家产量的总和。在打破外资垄断的同时还降低了价格,促进行业良性循环的同时也收获可观业绩增量。
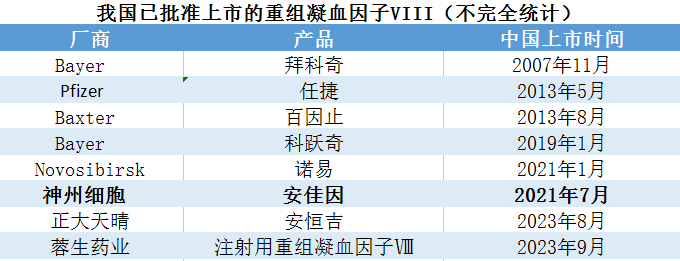
安佳因增长迅猛,上市后仅不到三年,便抢占拜耳、百特等控制的重组凝血八因子市场,2023年同类产品市场占有率第一,预计市场占有率在1/4-1/3之间。2021年上市首年,安佳因销售额达到1.34亿元;2022年,达到10.23亿元,突破10亿元;2023年前三季度高达13亿元,全年预计近19亿元。据不完全统计,除安佳因之前,我国已批准上市的重组凝血因子VIII还有:Bayer的拜科奇和科跃奇、Baxter的百因止、Pfizer的任捷和Novosibirsk的诺易,均为进口产品;本土另有正大天晴(安恒吉)和蓉生药业的重组凝血八因子分别于2023年8月、9月获批上市,另外本土还有晟斯生物等的4款同类产品处于临床3期,未来一场直接竞争不可避免。
数据来源:公开资料,制图:贝壳社
据悉,血友病是一种遗传性的终生性疾病,也是一种主要影响男性的罕见遗传性凝血障碍疾病,可分为甲型和乙型血友病,其中85%是缺少凝血因子Ⅷ的甲型血友病患者。该病导致患者长期反复的肌肉、关节出血并造成残疾,严重的出血甚至会导致死亡。目前全球血友病的患病率为十万分之5-10,我国的血友病患者约14万人。另外从市场需求来看,每年人源性八因子“按需治疗”和“预防治疗”的理论需求量分别约为449万瓶和972万瓶(200IU),2022年我国人源性八因子的批签发量约为247万瓶,市场渗透机会还很大。
此外,国内血液制品市场上白蛋白是主流产品,市场份额约59%,而凝血因子类小产品等高端市场所占份额仅约7%,而这一份额在国际市场为18%,再次印证凝血因子未来市场增长空间很大。
鉴于血友病市场的潜力,神州细胞除了不断开拓中国市场,还着手开发安佳因的海外市场。
目前,神州细胞已与印度、土耳其、印尼、斯里兰卡、巴西、巴基斯坦、沙特、阿尔及利亚、泰国、越南、菲律宾和哥伦比亚等发展中国家的合作伙伴签约,推动安佳因在当地商业化。预计从2025年开始,安佳因将在境外市场陆续上市。可以预见,未来,随着市场占有率的不断提升,以及出海进程的加快,安佳因将覆盖更大全球血友病市场,也将为神州细胞持续带来业绩增量。
瑞帕妥单抗注射液(安平希®)在2022年8月获批上市,不仅是神州细胞自主研发的首个抗体药物,还是首个国产新型抗CD20单抗。该药适用于新诊断CD20阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)成人患者。瑞帕妥单抗在价格上明显低于进口药(便宜10%到20%),切实助力我国淋巴瘤患者5年生存率提升。安平希2022年第四季度开始产生销售收入,报告期内取得营收1965.75万元。
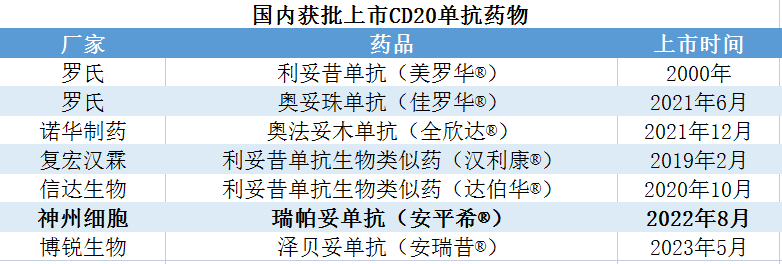
淋巴瘤是常见的恶性肿瘤之一,目前在中国的发病率约为6.68/10万,每年约有10万名新发淋巴瘤患者,其中约70%为非霍奇金淋巴瘤。而在非霍奇金淋巴瘤中,弥漫性大B细胞淋巴瘤(DLBCL)是最常见的侵袭性恶性淋巴瘤,相较于其他淋巴系统恶性肿瘤预后更差,发病人数和死亡人数均逐年递增。国内存在着迫切的未满足的临床需求。全球抗CD20单克隆抗体市场方面,2020年规模为113亿美元,2025年和2030年将分别达到111亿美元和152亿美元。中国方面,2020年抗CD20单克隆抗体市场规模为35亿元,2025年和2030年将分别达到98亿元和220亿元。2020年至2025年的年复合增长率为23.1%,2025年至2030年的年复合增长率为17.5%。目前,包含神州细胞的瑞帕妥单抗安平希在内,国内获批上市的CD20单抗药物共7款,包含3款进口和4款国产。3款进口:罗氏的利妥昔单抗(美罗华®)和奥妥珠单抗(佳罗华®)、诺华制药的奥法妥木单抗(全欣达®);4款国产:复宏汉霖的利妥昔单抗生物类似药(汉利康®)、信达生物的利妥昔单抗生物类似药(达伯华®)、神州细胞的瑞帕妥单抗(安平希®,原治疗用生物制品2类)、博锐生物的泽贝妥单抗(安瑞昔®,1类新药)。此外,国内还有正大天晴、齐鲁制药、君实生物、百奥泰等30多家研发机构布局CD20靶点。可以见得,瑞帕妥单抗未来将面临激烈竞争,不过依托迫切临床需求、价格优势等,未来可期。
除上述产品,神州细胞还有2023年6月获批的阿达木单抗生物类似药(安佳润®)以及贝伐珠单抗生物类似药(安贝珠®)。其中安贝珠一次性获批实体瘤六大适应症,进一步丰富公司在肿瘤治疗领域的商业化产品管线。上述两款药物持续为神州细胞带来业绩增量。此外,针对XBB/BQ1.1等变异株的4价迭代新冠疫苗SCTV01E-2已于2023年12月在国内被纳入紧急使用。另外,新冠病毒重组蛋白疫苗在阿联酋、约旦、老挝等多个国家获批开展多项 2/3期临床免疫原性和安全性研究。
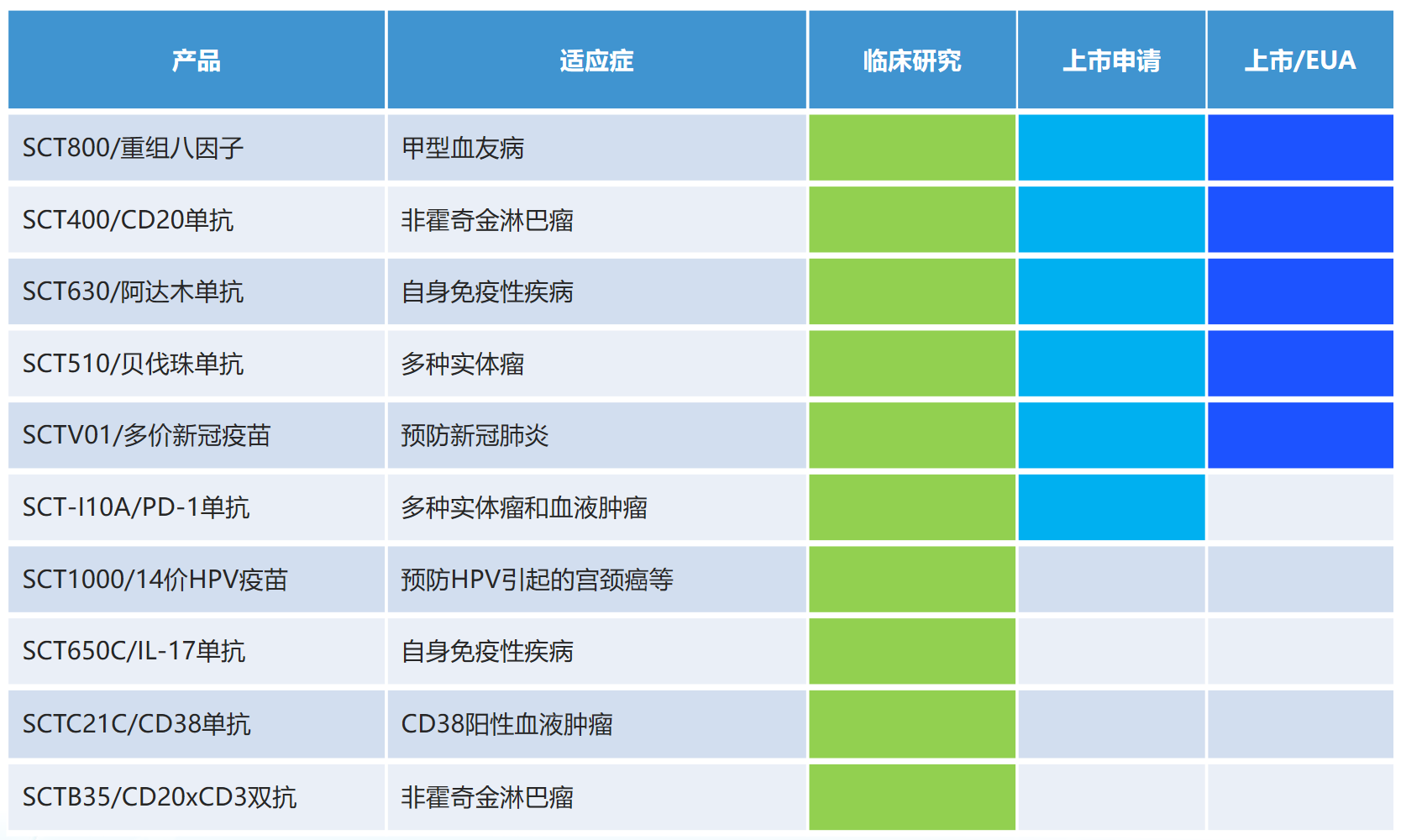
其他处于上市申请及临床阶段的药物有:PD-1菲诺利单抗(SCT-I10A),目前头颈癌及肝癌适应症均处于上市申请阶段;SCT-I10A上市申请获得药监局受理,适应症为头颈部鳞状细胞癌(HNSCC),有望成为首个用于治疗HNSCC的国产PD-1药物;自主研发的SCTC21C注射液获批临床试验,用于治疗CD38+血液系统恶性肿瘤;SCT-200,一款全人源EGFR单抗(IgG1亚型),用于治疗多种实体瘤,处于多项1期、2期临床研究阶段;SCT-650C,一款重组抗IL-17单克隆抗体,与IL-17结合后可抑制下游细胞因子,阻断炎症信号传导,拟用于治疗中重度斑块状银屑病,目前已在澳大利亚开展Ia期临床研究。还有针对多发性骨髓瘤的CD38单克隆抗体药物,针对包括罕见病、多种血液瘤及实体瘤在内的不同靶点的多个双特异性及三特异性抗体项目等。
2021年首款产品上市以来,神州细胞营收便爆发式增长,2021年、2022年分别增长408.5倍及6.61倍,2023年度实现营业收入18.87亿元,同比增长84.46%。不过坏消息是,自2020年科创板上市以来,神州细胞连年亏损,2023年还亏了3.96亿元,同比收窄23.7%;上年同期亏损5.19亿元。主要原因是大幅度的研发投入:2022年神州细胞研发总投入9.73亿元,较2021 年同比增长 32.86%,占营业收入比重达95.14%。2023年超过12亿元,占营收的比例达到64.5%。
事情总分两面,持续的研发投入是创新药企业保持技术和竞争优势的关键因素之一,从上述药物及未来前景来看,神州细胞基本面的边际已得到改善,已度过最艰难的时刻,未来随着优势药品的不断上市、放量,神州细胞将在多年创新坚守后迎来营收突破。参考资料:
1.神州细胞官网.
2.《神州细胞的「终极大招」在路上》,药智网 ,2024-02-04.
3.《神州细胞:一个创新药企的坚守与突破》,医药魔方,2024-02-04.
4.《神州细胞销售奇迹背后:高额补贴,患者买药“零自付” 》,健识局,2024-04-19.


文章评论(0)