首个BCMA CAR-T再次BLA获美国FDA受理,并授予优先审评
9月22日,百时美施贵宝(BMS)和蓝鸟生物(bluebird bio)联合宣布,美国FDA已接受了其BCMA CAR-T细胞免疫疗法idecabtagene vicleucel(ide-cel)治疗复发/难治性多发性骨髓瘤(R/R MM)的上市申请,并授予优先审评资格。
多发性骨髓瘤(MM)是仅次于非霍奇金淋巴瘤的第二大常见血液学恶性肿瘤。近年来,尽管在化疗、蛋白酶体抑制剂、免疫调节剂沙利度胺衍生物和CD38靶向抗体方面取得了很大进展,但几乎所有患者最终仍会复发。因此,该领域对新药的需求仍然迫切。
Ide-cel是一种靶向B细胞成熟抗原(BCMA)的嵌合抗原受体(CAR)T细胞免疫疗法,用于治疗接受过3种以上疗法(包括免疫调节剂,蛋白酶体抑制剂和抗CD38抗体)的成人多发性骨髓瘤的成年患者。此前,Ide-cel已经获得FDA突破性疗法认定,以及欧洲药品管理局的“优先开发药物”PRIME资格认定,也是全球首个提交上市申请的BCMA CAR-T疗法。
不过值得一提的是,ide-cel曾在今年3月向FDA提交了BLA,不过遭到了FDA的拒绝。据当时FDA的回复显示,ide-cel的上市申请需要更多数据,包括额外增加化学、制造和控制(CMC)模块方面的资料。直到今年7月,ide-cel的上市申请重新提交。
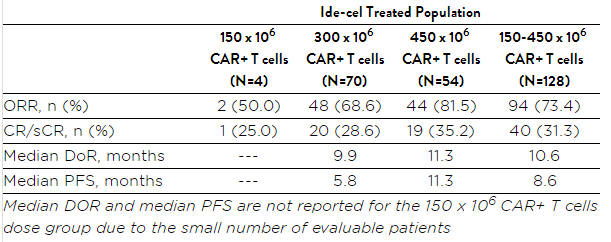
此次上市申请基于一项名为Karmma II期临床研究的数据。在2019年12月ASH会议上,Bluebird公开该研究的临床数据显示:所有接受治疗的患者均接受了至少三种先前的治疗方法,包括免疫调节剂(IMiD),蛋白酶体抑制剂(PI)和抗CD38抗体,并且所有患者均对其最后治疗无效。94%的患者对抗CD38抗体无效,而84%的患者对三重不应(对IMiD剂,PI和抗CD38抗体无效)。
而该试验研究达到了总缓解率(ORR)的主要终点和完全缓解率(CR)的关键次要终点。结果表明,在总计128名能够评估疗效的患者中,患者的客观缓解率达到73.4%,完全缓解率达到31.3%。在中位随访时间为11.3个月时,平均无进展生存期8.6个月。
BCMA则是一种跨膜糖蛋白,它属于肿瘤坏死因子(TNF)受体超家族,又被称为TNFRSF17或CD269。BCMA是一个极其重要的B细胞生物标志物,广泛存在于MM细胞表面,是MM和其他血液系统恶性肿瘤的热门免疫治疗靶点,业已成为继CD19之后第二大最受欢迎的抗癌细胞疗法靶点。
据新药研发监测数据库(CPM)显示,截止目前,针对BCMA这一靶点共有64个产品,涉及21个CAR-T在研,其中有6个产品由中国企业研发,如传奇生物、耀邦生物等等。


文章评论(0)