刚刚,两款进口新药上市申请获受理
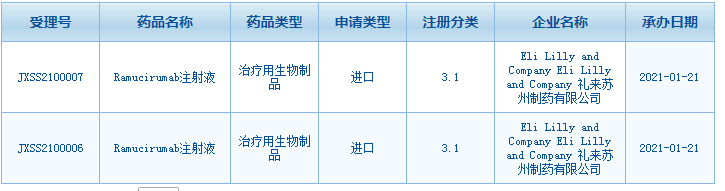
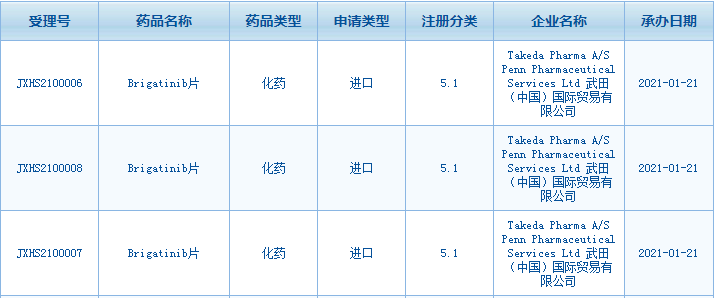
1月21日,礼来宣布国家药监局药品审评中心(CDE)已经批准其VEGFR-2单抗创新药ramucirumab的上市申请,ramucirumab则主要用于晚期胃癌二线治疗。与此同时,武田制药递交的5.1类进口新药 Brigatinib 的上市申请也获受理。
截图来源:CDE官网
据悉,Ramucirumab是一种与 VEGFR-2特异性结合的全人源IgG1单克隆抗体,可高效阻断VEGF-A与VEGFR-2的结合,亦能够抑制VEGF-C及VEGF-D与VEGFR-2的结合。
1月12日,礼来宣布Ramucirumab最新亚洲III期临床RAINBOW-Asia达到预设的研究终点,通过纳入440例来自东亚(中国、马来西亚、菲律宾和泰国)地区的一线化疗后进展的晚期胃癌或胃食管结合部腺癌患者,2:1随机给予Ramucirumab+紫杉醇或安慰剂+紫杉醇治疗。结果显示,Ramucirumab联合紫杉醇组患者中位无进展生存期 (PFS)较安慰剂组显著延长(mPFS 4.14 个月vs. 3.15个月;HR=0.765;p=0.0184),并显示出与全球关键注册临床试验RAINBOW一致的中位总生存期(OS)获益(HR=0.963)。患者整体耐受性良好,与Ramucirumab的已知安全特征一致,未观察到新的安全性信号。
世界卫生组织国际癌症研究机构(IARC)发布了最新的癌症负担数据显示,胃癌是我国发病数量第三高的恶性肿瘤,2020年我国新发胃癌病例数约为48万,约占全球新发胃癌病例的44%。
截图来源:CDE官网
Brigatinib(又名布加替尼)是一款 ALK 抑制剂,在 2020 年底美国 NCCN 发布的非小细胞肺癌(NSCLC)最新指南中,Brigatinib被推荐为 ALK 阳性晚期 NSCLC一线治疗首选用药。
基于III期ALTA-1L临床试验的结果,Brigatinib与克唑替尼相比较,患者使用后病情进展风险或死亡风险可降低两倍(PFS危险比= 0.49),Brigatinib的中位无进展生存期(PFS)为24个月,而克唑替尼仅为11个月;客观缓解率(ORR)为74%(95%CI:66–81),克唑替尼经确认的客观缓解率为62%(95%CI:53–70)。2020 年 5 月FDA 批准Brigatinib一线治疗 ALK 阳性转移性 NSCLC 成人患者。
截至目前,Brigatinib已在美国、加拿大和欧盟等40多个国家获得批准,用于既往接受过克唑替尼治疗但病情进展或无法耐受克唑替尼的ALK+转移性NSCLC患者。同时,Brigatinib还在美国和欧盟获准作为一种单药疗法,用于治疗既往未曾用过ALK抑制剂的ALK+晚期NSCLC成人患者。


文章评论(0)