拿下全球首款靶向CD19的ADC药物,ADC Therapeutics能改变亏损的局面吗?
继FDA加速批准靶向CD19的CAR-T疗法Monjuvi后,CD19又有新动态。
近日,FDA加速批准ADC Therapeutics(ADCT)靶向CD19抗体偶联药物Zynlonta(Loncastuximab tesirine-lpyl)上市,可作为单药用于经两种或两种以上全身疗法后复发或难治性(r/r)弥漫大B细胞淋巴瘤(简称r/r DLBCL),成为全球首款获批靶向CD19的ADC药物。
值得一提的是,Monjuvi与Zynlonta都可用于r/r DLBCL成人患者治疗,其中Monjuvi需联合来那度胺使用,是第一个获FDA批准用于一线治疗期间或治疗后病情进展的r/r DLBCL成人患者的二线疗法。
最常见的不良反应(≥20%)为血小板减少、γ-谷氨酰转移酶升高、中性粒细胞减少、贫血、高血糖、转氨酶升高、疲劳、低白蛋白血症、皮疹、水肿、恶心和肌肉骨骼疼痛。在LOTIS-2中,最常见的(≥10%)3级以上治疗引起的不良事件为中性粒细胞减少症(26.2%)、血小板减少症(17.9%)、γ-谷氨酰转移酶升高(17.2%)和贫血(10.3%)。
弥漫性大B细胞淋巴瘤(DLBCL)是最常见的非霍奇金淋巴瘤类型,是一种进展迅速的侵袭性疾病且具有多种亚型。超过40%的一线DLBCL疗法会失效,且预后往往不良。
Zynlonta 是与吡咯并苯并二氮(PBD)二聚体细胞毒素偶联的人源化靶向CD19的ADC药物, 当PBD二聚体进入细胞之后与DNA特异性结合,形成有效的细胞毒性DNA链间交联从而阻断细胞分裂并杀死癌细胞。其中,CD19是B细胞表面表达的特异性抗原,是多种CAR-T疗法的靶点。
值得一提的是,瓴路药业通过与ADCT成立合资公司Overland ADCT BioPharma,获得在大中华区和新加坡开发并推广Zynlonta的独家权益。今年3月,ADCT与瓴路药业联合申报的注射用Loncastuximab Tesirine项目已经获批临床,拟联合伊布替尼治疗经标准治疗失败或不耐受标准治疗的晚期r/r DLBCL或经一线标准治疗后复发或难治性套细胞淋巴瘤。
截图自CDE
此外,ADCT也计划开展多项临床试验,进一步探索Zynlonta与伊布替尼联用治疗套细胞淋巴瘤(MCL)、DLBCL以及单药治疗滤泡型淋巴瘤(FL)的潜力。
ADCT官网显示,除了Zynlonta,其管线还包括Camidanlumab tesirine(Cami)、ADCT-602、ADCT-601、ADCT-901及ADCT-701产品,并正在进行多项针对血液疾病和实体瘤适应症的临床试验。其中,Cami是目前进度最快的一款产品。
2020年12月,ADCT在ASH年会上公布Cami用于复发或难治性HL患者的关键性2期临床最新数据。结果显示,Cami单药治疗复发或难治性HL患者,ORR为83%,CRR为38.3%。
此外,Cami联合pembrolizumab用于实体瘤1b期试验的药代动力学和生物标志物数据已在2020年ESMO上公布,临床前数据也发表在Journal for ImmunoTherapy of Cancer上。
目前,ADCT-602正在被用于复发性或难治性B细胞患者的I/II期临床试验(NCT03698552)。
目前,ADCT-601正在被用于选定的晚期实体瘤患者的评估试验(NCT03700294)。
目前,ADCT-901正在被开发用于治疗晚期实体肿瘤,包括耐铂卵巢癌和三阴性乳腺癌。
目前,ADCT-701正在被开发用于治疗晚期实体瘤、神经母细胞瘤、HCC和SCLC。
虽然ADCT目前拥有众多在研产品,但大多属于全新靶点,且均处于临床或临床前研究阶段,存在较大的研发风险。因此,ADCT的前景并不乐观。
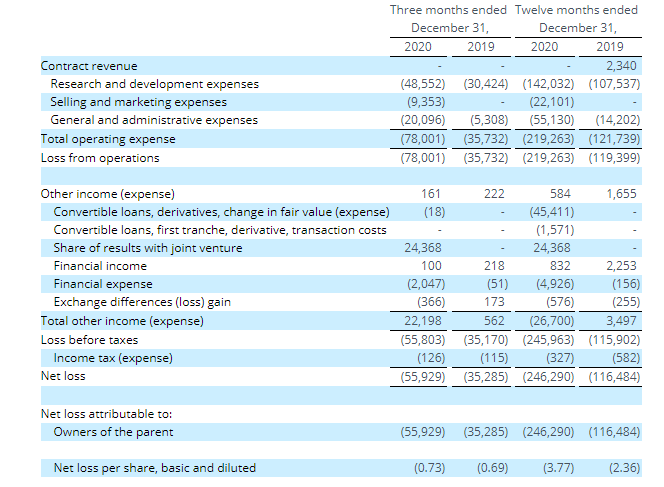
今年3月,ADCT公布其2020第四季度及全年财务业绩。截至2020年12月31日,其第四季度研发支出为4860万美元,全年为1.42亿美元,而2019年同期和全年的支出分别为3040万美元和1.075亿美元。
此外,2020年第四季度,为推进Zynlonta上市计划,共产生营销支出940万美元,全年为2210万美元。而2019年之前未存在类似支出。2020年公司上市,由于股份薪酬支出和上市公司成本的增加,一般和行政费用从2019年的1420万美元增长至5510万美元。
截图自ADCT官网
因此,2020年全年净亏损为2.463亿美元。
结合ADCT之前发布的公告,其2017年全年净亏损8990万美元,2018年全年净亏损为1.231亿美元,2019年全年净亏损为1.165亿美元。近4年累计亏损5.758亿美元(约37.35亿元)。
值得一提的是,2020年5月,ADCT在纽约证券交易所完成2.676亿美元的首次公开募股。而在此之前,ADCT曾因市场情况不明在上市前夕撤销在纳斯达克上市的申请。
现如今,随着产品陆续进入临床试验阶段,以及继续扩大Zynlonta在早期治疗和多种适应症方面的潜在市场机会,预计ADCT在研发和市场化的投入将进一步增加。
此外,Zynlonta上市后也面临着比较激烈的竞争。仅2020年FDA就批准多款针对r/r DLBCL的疗法,主要包含:一、Xpovio(selinexor),用于治疗接受过至少两种系统疗法的r/r DLBCL成人患者,包括滤泡性淋巴瘤(FL)引起的DLBCL。Xpovio是目前用于治疗r/r DLBCL的唯一一种单药口服疗法,也是首个且唯一一个获FDA批准可同时用于骨髓瘤和DLBCL的药物;二、Monjuvi,可联合来那度胺(lenalidomide),用于治疗不适合自体干细胞移植(ASCT)的r/r DLBCL成人患者,包括源于低级别淋巴瘤的DLBCL;三、Pola,可联合BR(苯达莫司汀、利妥昔单抗)用于治疗不适合移植的r/r DLBCL患者。
与Xpovio、Monjuvi相比,Zynlonta目前治疗范围相对单一,竞争压力较大,而对ADCT来说,单靠Zynlonta短期内恐怕无法改变其当下亏损的现状。不过此次Zynlonta获批上市,也意味着ADCT在商业化布局上迈出成功的第一步,后续发展如何,还需拭目以待。
有关ADCT的最新动态,贝壳社将继续保持关注。



文章评论(0)