重磅!默沙东Keytruda组合疗法获FDA加速批准,用于胃癌一线治疗
截图自FDA官网
其中,Keytruda是一种人源化单克隆抗体,可阻断PD-1及其配体PD-L1和PD-L2之间的相互作用,从而激活T淋巴细胞以消灭癌细胞。
截至目前,Keytruda已经获FDA批准用于多种癌症治疗,其中包含黑色素瘤、肺癌、胃癌、宫颈癌、肝细胞癌、肾细胞癌、子宫内膜癌、膀胱癌、尿路上皮癌、食管癌、胃癌等,成为当下获批适应证最多的抗PD-1单抗。
此外,Keytruda也在国内获批用于肺癌、黑色素瘤、食管癌、头颈部鳞状细胞癌的治疗。
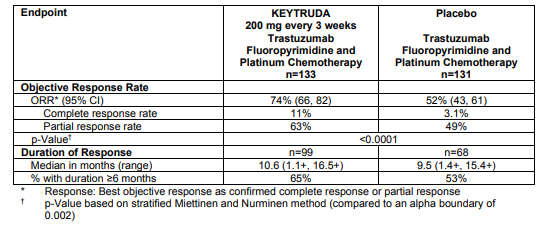
因此,面对死亡率较高的全球第五大常见癌症,胃癌新药正在被加速批准,仅2021年1月至今,FDA就已批准3款胃癌新药。其中,2021年1月,FDA批准阿斯利康与第一三共的HER2靶向ADC药物Enhertu,用于治疗HER2阳性转移性胃癌或胃食管结合部(GEJ)腺癌患者;2021年4月,FDA批准百时美施贵宝(BMS)的PD-1抑制剂Opdivo(nivolumab)与化疗联用,用于晚期或转移性胃癌、胃食管结合部(GEJ)腺癌和食管腺癌的一线疗法;5月6日,FDA再次加速批准默沙东抗PD-1疗法Keytruda与曲妥珠单抗、含氟嘧啶和铂类化疗联合,用于局部晚期不可切除或转移性HER2阳性胃癌或胃食管结合部(GEJ)腺癌患者的一线治疗。
此外,2021年3月,FDA授予Ambrx靶向HER2的ADC药物ARX788孤儿药资格,用于治疗HER2阳性胃癌,包括胃食管结合部腺癌;荣昌生物的维迪西妥单抗是国内首个自主研发靶向HER2的ADC新药也将获NMPA批准上市,用于局部晚期或转移性胃癌(包括胃食管结合部腺癌),此前该药物也获得FDA突破性疗法认定,拟用于HER2表达的(IHC 2+或IHC 3+)局部晚期或转移性尿路上皮癌二线治疗。
期待更多胃癌新药获批,为患者提供全新选择。


文章评论(0)