3款药物同时获CDE批准纳入拟优先审评
5月12日,国家药品监督管理局审评中心(CDE)官网显示,豪森药业的甲磺酸阿美替尼片、云顶药业的注射用戈沙妥组单抗及万春医药的注射用普那布林浓溶液同时被拟纳入优先审评通道。
截图自CDE
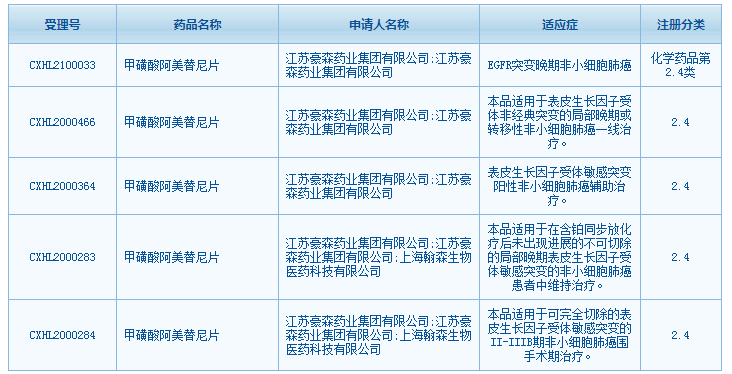
一、甲磺酸阿美替尼片
拟用于:具有表皮生长因子受体外显子19缺失或外显子21(L858R)置换突变的局部晚期或转移性非小细胞肺癌成人患者的一线治疗
公司:豪森药业
截图自CDE
甲磺酸阿美替尼为表皮生长因子受体的激酶抑制剂,是我国自主研发并拥有自主知识产权的创新药。2020年3月,国家药品监督管理局(NMPA)批准江苏豪森药业自主研发1类创新药阿美乐(甲磺酸阿美替尼片)上市,用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗进展,且T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。
阿美乐是全球第二个三代EGFR-TKI创新药,也是全球首个中位无进展生存期(mPFS)超过1年(二线使用)的三代EGFR-TKI,且对脑转移有效,临床优势明显。2020年12月,阿美乐正式被纳入医保。
据CDE官网显示,甲磺酸阿美替尼在国内正在进行多项临床试验,此次递交的新适应症上市申请为具有表皮生长因子受体外显子19缺失或外显子21(L858R)置换突变的局部晚期或转移性非小细胞肺癌成人患者的一线治疗,如若获批,可为该类型非小细胞肺癌患者带来新选择。
截图自CDE
二、注射用戈沙妥组单抗
拟用于:治疗接受过至少2线既往治疗的转移性三阴乳腺癌成人患者
公司:云顶药业
截图自CDE
注射用戈沙妥组单抗是一款靶向人滋养层细胞表面抗原2(Trop-2)的抗体偶联药物,2020年4月该药物获FDA批准用于治疗既往已经接受2种以上疗法的成人转移性三阴乳腺癌患者,是全球首个获批治疗三阴乳腺癌的ADC药物,也是在国内首款申报上市的Trop-2 ADC药物。
三阴乳腺癌是一种高度侵袭性疾病,约占全球所有乳腺癌类型的15%。近10年来,三阴乳腺癌分子亚型的比例逐步上升,且内分泌疗法或HER2靶向治疗基本无效。在过去20多年中,三阴乳腺癌患者的总生存期一直没有得到改善,亟待开发新的有效治疗方案。
据悉,注射用戈沙妥组单抗由Immunomedics研发,2019年云顶生物通过8.35 亿美元的交易获得该药物在大中华区、韩国及部分东南亚国家的独家权益。
近日,第一三共和阿斯利康在2021年欧洲医学肿瘤内科学会(ESMO)乳腺癌年会上公布其Trop-2 ADC药物datopotamab deruxtecan(DS-1062)在标准治疗后转移性三阴乳腺癌患者疾病进展的临床反应和疾病控制结果,数据显示,在接受4mg/kg及以上剂量DS-1062的患者中,初步ORR为43%。而国内也有两家企业在布局Trop-2靶点,分别为科伦的SKB264和上海君实生物的JS108。
三、注射用普那布林浓溶液
拟用于:与聚乙二醇化重组人粒细胞刺激因子联合应用,适用于成年非髓性恶性肿瘤患者化疗导致的中性粒细胞减少症(CIN)
公司:万春医药
截图自CDE
注射用普那布林溶液是一种“first-in-class”鸟嘌呤核苷酸交换因子(GEF-H1)激活剂,可通过逆转由化疗药物诱导的骨髓中嗜中性粒细胞的阻断形成,维持中性粒细胞水平在正常范围内,达到早期保护骨髓中白细胞的作用,以减少早期中性粒细胞减少症的发生。
2020年9月,普那布林同时获得NMPA和FDA授予的突破性疗法认定。此前,万春医药也发公告称,在一项普那布林与培非格司亭联合治疗乳腺癌的国际多中心3期研究PROTECTIVE-2中,普那布林达到了主要终点和所有次要终点。
目前,普那布林有多项全球3期多中心临床试验正在进行,其中两项是普那布林在预防中或高风险化疗引起的中性粒细胞减少症的临床研究,还有一项是普那布林联合多西他赛治疗非小细胞肺癌的临床研究。






文章评论(0)