科济药业今日港股IPO:专攻实体瘤CAR-T疗法,市值超170亿港元
众所周知,CAR-T是当今肿瘤治疗领域最具研究前景的方向之一,在血液瘤治疗方面取得了重大突破,但在实体瘤中一直未有突破,因此攻破实体瘤是CAR-T领域目前最大的挑战之一。
作为为数不多的主要专注于治疗实体瘤和血液恶性肿瘤的CAR-T细胞疗法企业,科济药业自成立以来,一直备受瞩目。“科济之所以侧重于开发实体瘤CAR-T疗法,是因为实体瘤占所有肿瘤的90%以上,有更多的患者需求,当然挑战也更大。”科济生物创始人兼CEO李宗海博士在接受媒体采访时曾表示。
本次IPO后,科济药业也成为国内继传奇生物、永泰生物、药明巨诺及亘喜生物后第5家CAR-T细胞疗法上市公司。

截图自招股书
虽持续亏损,但科济药业已建立了自己的细胞治疗平台,并基于该平台自主开发了11款具有差异化的候选产品,以治疗恶性血液瘤及实体瘤。目前,科济药业已在中国、美国和加拿大获得7个CAR-T疗法的IND许可。根据弗若斯特沙利文的资料,这在国内所有CAR-T企业中排首位。
此外,为了满足产品商业化的生产需求,科济药业已建立了符合GMP的覆盖质粒生产、慢病毒载体生产和CAR-T细胞生产的端对端内部制造能力。
根据招股书,本次IPO募集资金将主要用于进一步开发其核心候选产品BCMA CAR-T(CT053),并为其他管线候选产品的研发活动提供资金,及培养全面的制造及商业化能力等。
科济药业此次IPO,共引入9名基石投资者,包括礼来亚洲基金、新华人寿、奇点资产管理、睿远、WT、广发证券、dymon Asia、常春藤、南方基金,共投资2.3亿美元,占募资上限约57.44%。
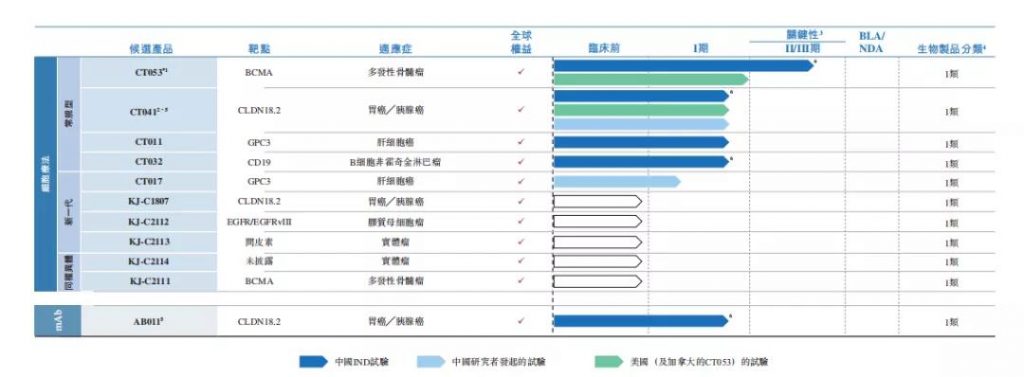
此外,科济药业表示,将于2022年向NMPA递交CT053的上市申请并完成商业化布局。如若一切顺利,CT053将是科济药业首个获批上市的CAR-T产品。
CT041则是一款靶向CLDN18.2的重磅CAR-T产品,拟开发用于治疗胃癌、胰腺癌等实体瘤的治疗。CT041已获得FDA授予的孤儿药资格,用于治疗胃腺癌和食管胃结合部腺癌。目前,CT041已在国内和美国展开临床试验,且表现出了良好的治疗效果及安全性。
CT011是一种针对GPC3的自体CAR-T候选产品,拟开发用于治疗肝细胞癌(HCC)。目前,CT011已经在国内启动了一项I期临床试验。
CT032是一款针对CD19的自体CAR-T候选产品,拟开发用于治疗B细胞非霍奇金淋巴瘤(NHL)。根据其招股书,CT032通过结合人源化的CD19特异性单链片段变体,有望降低药物毒性与免疫原性。目前,该产品正在国内进行一项开放、单臂的I/II期研究。
AB011是一款开发用于治疗CLDN18.2阳性实体瘤的候选产品。临床前研究显示,AB011对CLDN18.2阳性肿瘤细胞表现出很强的抗肿瘤活性。目前,AB011正在国内开展治疗CLDN18.2阳性实体瘤的I期临床研究。
CT017是一款含有转录因子并靶向GPC3的自体CAR-T候选产品,目前正处于由研发者发起的试验阶段。
Nature Reviews Drug Discovery 期刊最近发表的一项研究显示,在不同类型的细胞疗法中,CAR-T细胞疗法一直占据主导地位,截至2021年4月16日,CAR-T细胞疗法共增加299种新药,比2020年同期增加了35%,且80%的CAR-T疗法处于临床前和临床I 期阶段。
而据Clinical Trials统计,截至 2020 年 6月30日,全球 CAR-T 细胞疗法的临床试验登记项目超600项,其中中国以357项临床试验位居全球首位。随着传奇生物、永泰生物、药明巨诺及亘喜生物相继上市后,国内CAR-T细胞疗法竞争也愈发激烈。
不过,国内仍未有任何一款CAR-T细胞疗法获批上市。进展比较快的,传奇生物自研的LCAR-B38M已向FDA及EMA递交上市申请,有望成为继Abecma之后第二款获批上市治疗R/R MM的国产CAR-T疗法。
复星凯特与药明巨诺两款靶向CD19的CAR-T细胞疗法也已向NMPA递交NDA,将于2021年获批,但这两款药物均为引进产品,复星凯特与药明巨诺仅拥有其在国内的权益。
对比起来,科济药业自主研发的靶向BCMA的CAR-T疗法,用于治疗R/R MM,目前处于临床I/II期,或将在LCAR-B38M之后获批。
不过,目前CAR-T治疗费用较高,是很多患者不可承受之重,即便产品获批,高昂的价格或也是阻碍规模化的一个重要因素,这是摆在国内CAR-T企业商业化之路上不得不考虑的现实问题。其他技术层面等的因素这里就不再赘述了。
总之,对于科济药业而言,跟其他几家已上市的企业一样,上市只是进入了一个新的阶段,更多的挑战和考验还在后头。


文章评论(0)