破局!中国首款CAR-T细胞疗法获批上市,来自复星凯特
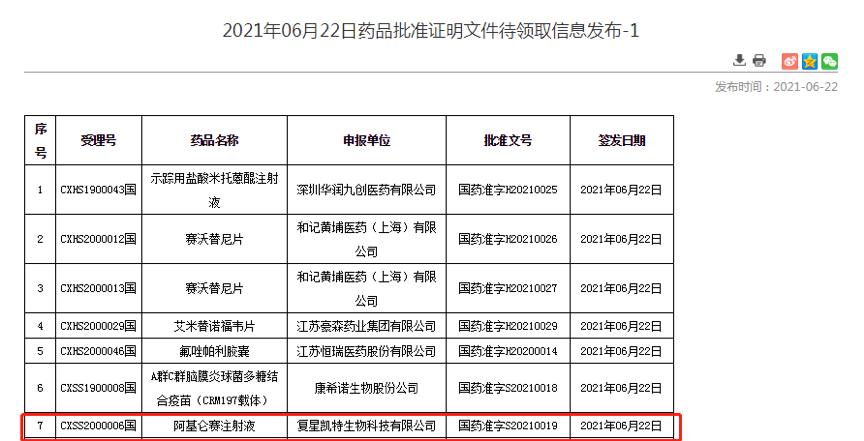
截图自NMPA
这也意味着,国内迎来了首款获批上市的CAR-T细胞疗法。至此,中国CAR-T疗法终打破黎明,正式步入商业化道路。
近日,复星凯特也表示已收到国家药品监督管理局关于同意其CD19靶点自体 CAR-T细胞治疗产品阿基仑赛注射液(产品代号FKC876)的临床批准,用于治疗接受过二线或以上系统治疗后复发或难治性惰性非霍奇金淋巴瘤(r/r iNHL),包含滤泡性淋巴瘤(FL)和边缘区淋巴瘤(MZL)开展临床试验的批准,这将是阿基仑赛注射液在国内获批的第二项适应症。
Yescarta是一种抗CD19 CAR-T细胞,通过基因工程修饰,使自体T细胞表达靶向B细胞肿瘤抗原CD19的分子,由激活的T细胞介导来杀伤肿瘤细胞。2017年,Yescarta获FDA批准上市,用于难治性或复发性大B细胞淋巴瘤,包括弥漫性大B细胞淋巴瘤(DLBCL),原发性纵隔大B细胞淋巴瘤(PMBCL)及转化性滤泡淋巴瘤(TFL),成为全球首款获批用于非霍奇金氏淋巴瘤(NHL)的CAR-T药物;随后,Yescarta获欧洲EMA批准,用于DLBCL及PMBCL的治疗;今年3月,FDA再次批准Yescarta用于治疗惰性非霍奇金淋巴瘤。
公开资料显示,阿基仑赛注射液是是复星凯特从吉利德子公司Kite制药引进Yescarta技术,并获授权在中国进行本地化生产的靶向CD19自体CAR-T细胞治疗产品。根据协议,复星凯特拥有其在中国包括香港、澳门的商业化权利。
据悉,阿基仑赛注射液此次获批基于一项名为ZUMA-1的注册临床试验研究,101例复发/难治性大B细胞淋巴瘤成人患者的长期随访数据显示,随访≥4年(中位数,51.1个月),通过Yescarta治疗给患者带来了持久的缓解,中位总生存期(OS)为25.8个月,4年OS率为44%。
但阿基仑赛注射液在国内的获批并不顺利。
2018年复星凯特的阿基仑赛注射液获批临床;新药上市申请也于2020年获NMPA正式受理并被纳入优先审评程序;2021年1月,本该获批上市的阿基仑赛注射液却因存在其他问题遭延迟上市,在历经5个月的补充上市申请后,阿基仑赛注射液终正式获批。
众所周知,CAR-T细胞疗法由于成本较高往往定价也相对偏高,譬如Kymriah一次性收费为47.5万美元;Yescarta为37.3万美元,均远超目前传统治疗的收费标准,因此,能够负担该疗法的患者群体少之又少,而这也是导致销售额不高的主要原因之一。
且从2017年FDA批准第一款CAR-T疗法至今,不到4年时间虽已有6款细胞疗法陆续获批,但4款靶向CD19的CAR-T可用于同一适应症,市场已趋红海。
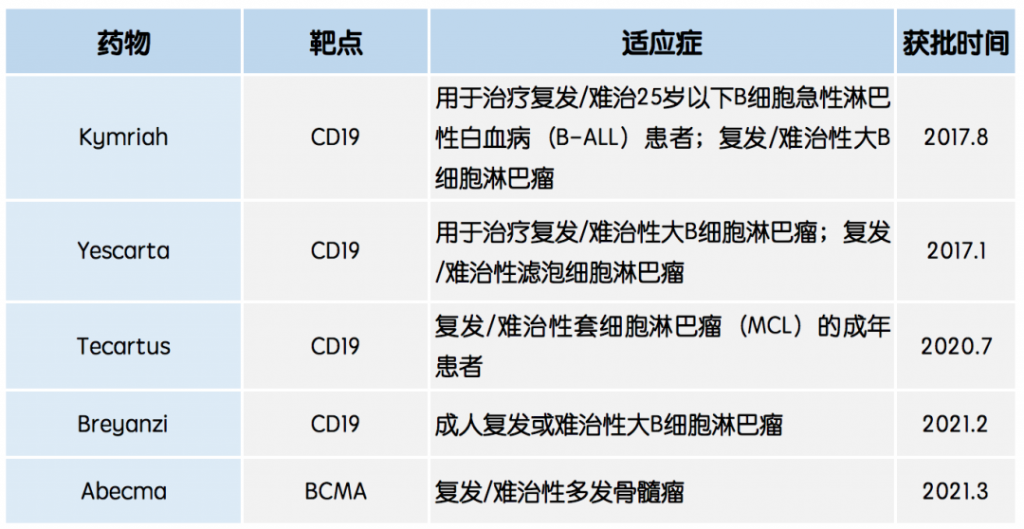
全球获批CAR-T产品靶点及适应症
据Clinical Trials统计,截止2021年5月底,全球有1301项CAR-T临床试验正在展开,而中国的CAR-T临床试验数量自2016年起呈现“井喷”,目前已达478项,位居全球首位。其中,传奇生物的LCAR-B38M、科济生物的CT053及合源生物的CNCT19等CAR-T疗法进展较快且已被CDE纳入突破性治疗品种,而药明巨诺通过引进的CD19 CAR-T产品瑞基仑赛注射液已向NMPA递交上市申请,用于复发难治性B细胞非霍奇金淋巴瘤,将成为国内获批的第二款CAR-T产品。
不过整体来看,国内CAR-T临床试验大多以CD19及BCMA为靶点,目标适应症则主要集中在B细胞淋巴瘤、非霍奇金淋巴瘤、白血病三大类,竞争激烈且同质化严重。
值得一提的是,阿基仑赛注射液此次拿下国内首个CAR-T产品,目前虽未公布定价,但作为国外引进产品,大量的资金投入很有可能导致其在国内的定价不低于Yescarta的37.3万美元。加之,国外已经将CAR-T细胞疗法纳入医保,大大降低患者用药负担,而目前业内普遍认为,国内的医保为CAR-T买单不现实。因此,该药物在国内的市场究竟如何,还需进一步验证。
复星凯特CEO王立群博士也曾表示:“作为中国免疫细胞治疗领域的产业化先驱者,复星凯特相信如果阿基仑赛注射液能在中国获批上市,将为中国肿瘤患者带来革命性的治疗方案。我们还希望与各级政府、医院、慈善基金、商业保险公司等积极展开合作,探索患者援助计划和创新支付模式,减轻患者的支付压力,惠及更多淋巴瘤患者。”
总的来说,作为国内首款获批的CAR-T细胞疗法产品,阿基仑赛注射液获批上市意义重大,但国内CAR-T行业竞争日趋激烈及价格高昂,也是玩家们在商业化过程中不得不考虑的现实问题。


文章评论(0)