正大天晴PI3K抑制剂获CDE拟突破性疗法认定
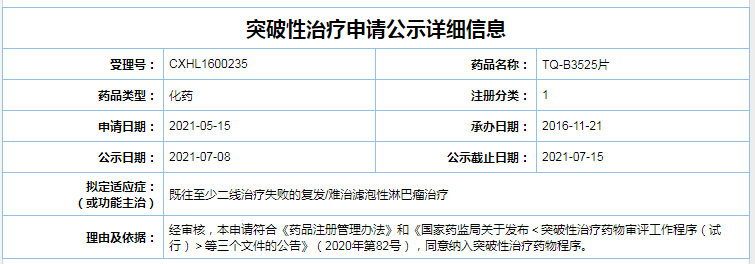
7月8日,国家药品监督管理局药品审评中心(CDE)官网显示,正大天晴药业集团股份有限公司(正大天晴)的PI3K抑制剂TQ-B3525片被纳入拟突破性治疗品种名单,拟用于既往至少二线治疗失败的复发/难治滤泡性淋巴瘤治疗。
截图自CDE
PI3K又称磷脂酰肌醇-3-激酶,其中PI3Kα、PI3Kβ、PI3Kδ、PI3Kγ四个亚型由于其在癌症发生和进展中起重要作用,目前已成为癌症靶向药开发的热门靶点之一。
据悉,TQ-B3525片是正大天晴研发的一种全新化学结构的1类新药,为新型PI3Kα/δ双重抑制剂,可克服单独抑制PI3Kδ亚基时引起的PI3Kα亚基活性上调而引发的耐药问题。除了可用于复发/难治滤泡性淋巴瘤(FL)的治疗,TQ-B3525亦在同时进行复发/难治性弥漫大B细胞淋巴瘤(DLBCL)、复发/难治性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL) 及复发/难治性外周 T 细胞淋巴瘤(PTCL)3项适应症在内的II期临床试验。
据统计,全球共有4款PI3K 抑制剂获批上市,其中吉利德的idelalisib是全球首个获批的PI3K抑制剂,拜耳的copanlisib是全球首个用于治疗滤泡性淋巴瘤的PI3Kα抑制剂, Verastem的duvelisib是一种能够同时抑制PI3Kδ和PI3Kγ的双重抑制剂,诺华的alpelisib是首个获批用于乳腺癌治疗的药物。
国内尚未有一款PI3K抑制剂获批上市,但拜耳的Copanlisib已在国内申报上市,罗氏的GDC-0077 和 Taselisib均处于III期临床阶段。而国内药企中信达的Parsaclisib片、正大天晴的TQ-B3525、石药集团的Duvelisib、和记黄埔的HMPL-689、圣和药业的SHC014748M均处于II期临床研究阶段,且信达的Parsaclisib片及正大天晴的TQ-B3525用于复发性或难治性滤泡性淋巴瘤的适应症均已获突破性疗法认定。


文章评论(0)