康方生物/正大天晴PD-1单抗即将获批,国内第七款!
近日,康方生物/正大天晴1类新药「派安普利单抗注射液」的上市申请(相关受理号为CXSS2000022)在NMPA的状态变更为“在审批”,预计不日将正式获批,成为国内批准的第7款PD-1单抗,同时也将成为国内批准的第五款国产PD-1单抗。
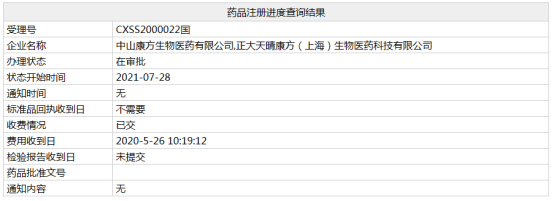
派安普利单抗(AK105)是康方生物自主研发的重组人源化抗 PD-1 单克隆抗体,是目前唯一采用IgG1亚型且经Fc段改造的新型PD-1单抗,抗原结合解离速率更慢,晶体结构分析显示其具有独特的结合表位,能够持久阻断PD-1/PD-L1结合。2019年9月,康方生物与正大天晴签订合营合同,成立合资公司,共同推进派安普利单抗商业化。据合同正大天晴获得派安普利单抗在中国的独家销售权。
此次派安普利单抗即将在国内获批的适应症是至少经过二线系统化疗复发或难治性(r/r)经典型霍奇金淋巴瘤(r/r cHL)。2021ASCO上公布的派安普利单抗治疗复发/难治性经典型霍奇金淋巴瘤的I/Ⅱ期研究AK105-201结果显示:截止2020年11月8日,该研究共入组94例至少接受过两线系统化疗的患者r/r cHL患者,经过中位 15.8 个月的随访,派安普利单抗治疗的ORR 高达 89.4%,CR率达47.1%。中位 PFS 尚未达到,12个月时的PFS率为72.1%;18个月时的OS率为 100%;中位 DoR 尚未达到。安全性方面,≥3 级TRAEs的发生率为26.6%,治疗相关SAE的发生率为10.6%;3 级免疫治疗相关不良事件(irAEs)的发生率仅为 4.3%,未观察到CTCAE 4或5级irAEs。
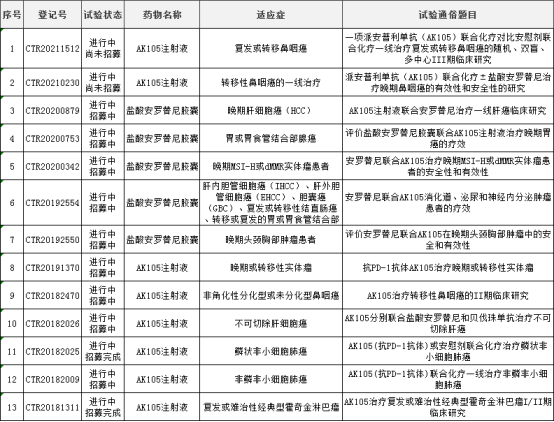
据CDE药物临床试验登记与信息公示平台,派安普利单抗在国内还被开发用于治疗鳞状NSCLC、非鳞NSCLC、肝细胞癌、鼻咽癌、胃或胃食管结合部腺癌等肿瘤,而且还联合安罗替尼被开发用于治疗多种肿瘤。
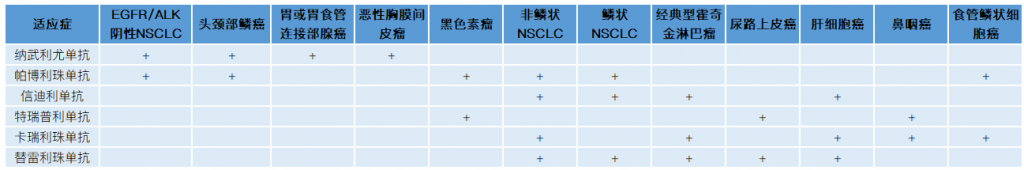
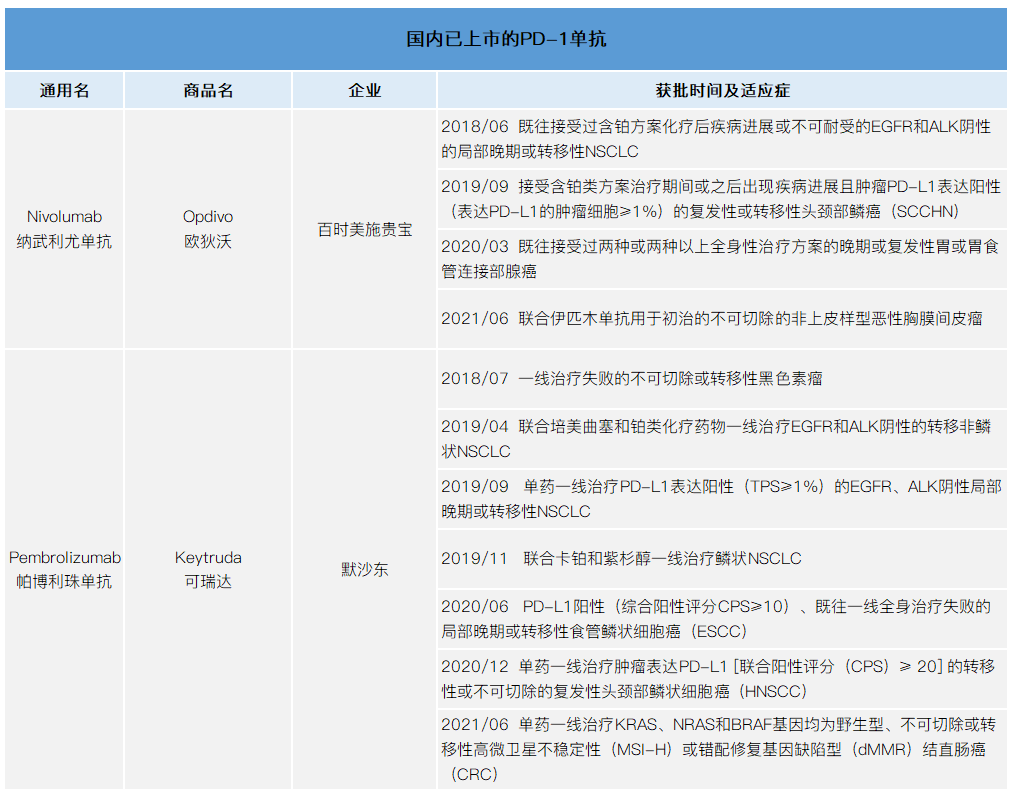
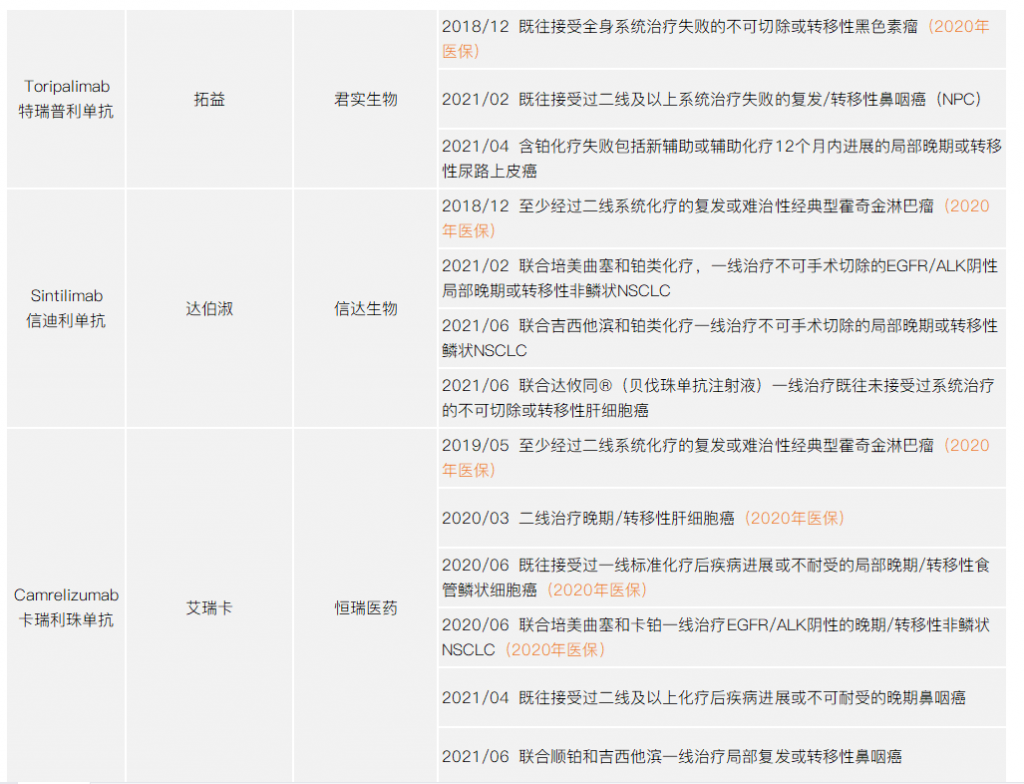
 从已获批的适应症看,目前国内PD-1单抗获批的适应症范围越来越大。从单个适应症看,大多有两款PD-1单抗已获批。
从已获批的适应症看,目前国内PD-1单抗获批的适应症范围越来越大。从单个适应症看,大多有两款PD-1单抗已获批。
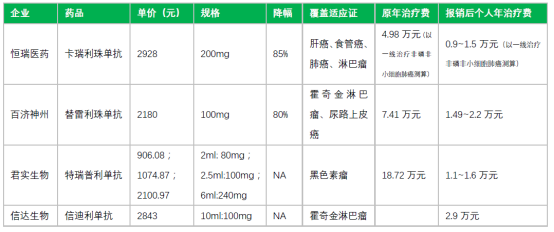
此外,特瑞普利单抗和信迪利单抗也已在美国递交BLA。诺华在公布第一季度财报时表示将于今年向FDA递交替雷利珠单抗二线治疗NSCLC、二线治疗食管鳞癌的上市申请。卡瑞利珠单抗于2021年4月被FDA授予治疗肝细胞癌的孤儿药资格认定。
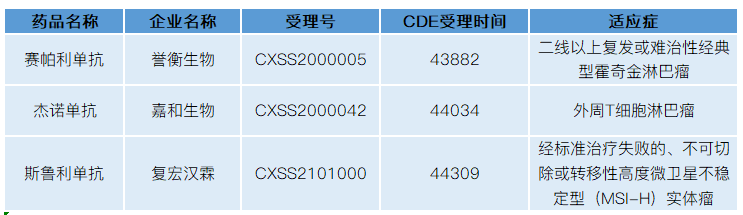
除了上述提及PD-1单抗,目前国内还有几款PD-1单抗处于上市申请阶段,详见下表。暂且不提众多在研PD-1单抗,仅从上述信息就可以看出国内PD-1单抗市场竞争已相当激烈。
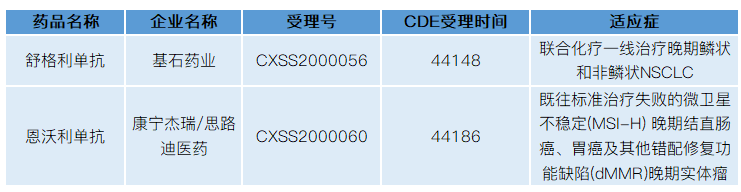
此外,PD-1单抗还面临着PD-L1单抗的竞争。目前国内已经获批的2款PD-L1单抗,即罗氏的阿替利珠单抗(商品名:泰圣奇,Tecentriq)和阿斯利康的度伐利尤单抗(商品名:英非凡,Imfinzi)。
而且,目前国内还有两款国产PD-L1单抗报产,即基石药业的舒格利单抗和康宁杰瑞/思路迪医药的恩沃利单抗。其中舒格利单抗(CS1001)是基石药业基于从美国Ligand公司引进的OmniRat®转基因动物平台开发的一款靶向PD-L1的全人源IgG4单抗。恩沃利单抗(KN035)是康宁杰瑞自主研发重组人源化PD-L1单域抗体Fc融合蛋白,其中思路迪医药负责其肿瘤适应症在全球的临床开发和商业化,先声药业负责其在中国大陆商业化推广,而且恩沃利单抗是全球首个且唯一一个处于BLA阶段的皮下注射PD-L1抗体。
作者:亦
声明:本文为作者独立观点,不代表贝壳社公众号立场,仅做分享交流。如需转载,请留言。


文章评论(0)