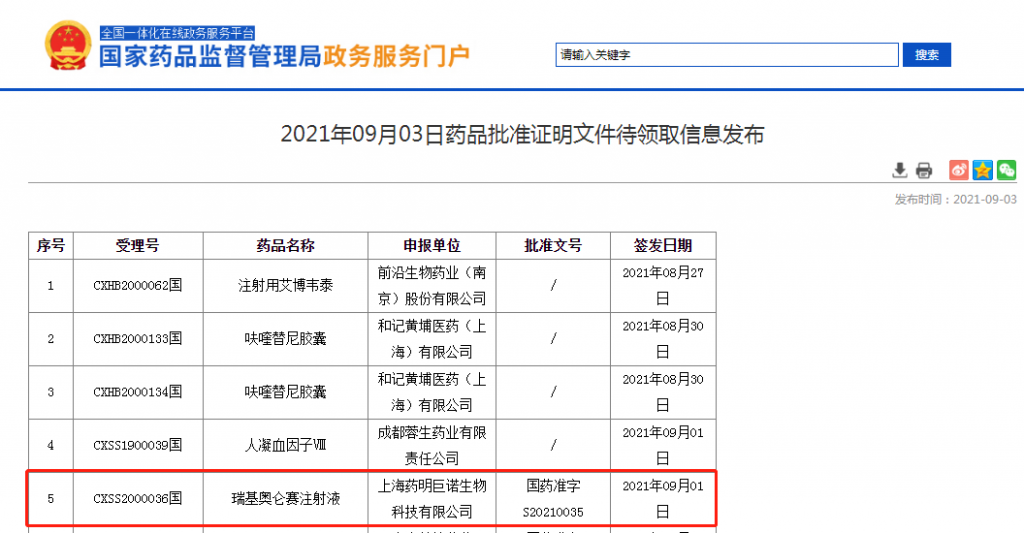
国内第2款 药明巨诺瑞基奥仑赛正式获批
9月3日,据国家药品监督管理局(NMPA)最新公示,药明巨诺的瑞基奥仑赛注射液正式获批上市,用于治疗经过二线或以上全身性治疗后成人患者的复发或难治性大B细胞淋巴瘤。
其中,药明巨诺是一家专注于最新细胞治疗技术领域的临床阶段的创新型生物科技公司,由药明康德集团和Juno Therapeutics(Juno)公司在2016年共同创建,该公司结合了Juno在嵌合抗原受体技术(CAR-T)和T细胞受体(TCR)技术,以及药明康德的研发生产平台及公司丰富的中国本地市场经验,为血液肿瘤和实体肿瘤病人开发创新的细胞免疫疗法。
而此次获批的瑞基奥仑赛是药明巨诺首个商业化产品,也是继阿基仑赛之后在国内获批的第2款CAR-T产品。
1、国内第2款,药明巨诺瑞基奥仑赛正式获批
据悉,瑞基奥仑赛(relma-cel)是建立在Breyanzi的基础上,由药明巨诺自主开发的靶向CD19 CAR-T产品。
其中,Breyanzi是一款靶向CD19的CAR-T疗法,包含4-1BB共刺激域,4-1BB信号可增强Breyanzi的扩增和持久性。今年2月,FDA批准Breyanzi用于治疗经过两次或两次以上系统治疗的复发或难治性大B细胞淋巴瘤成年患者,包括弥漫性大B细胞淋巴瘤(DLBCL)(包括惰性淋巴瘤引起的DLBCL)、高级别B-细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤和3B级滤泡性淋巴瘤。此外,该药在日本还被批准用于治疗复发或难治性滤泡性淋巴瘤(R/R FL),并在欧盟被授予治疗R/R DLBCL的优先药物(PRIME)资格。
而瑞基奥仑赛通过使用鼠源的scFv重组抗体形式,可在保留了原始免疫球蛋白对抗原的特异性同时增强肿瘤穿透力。且瑞基奥仑赛T细胞表达的CAR与CD19的胞外域结合,致使CAR的胞内域促进T细胞扩增并触发效应功能以清除肿瘤细胞。
2017年12月,药明巨诺通过其关联公司明聚生物向国家药品监督管理局递交瑞基奥仑赛用于复发难治淋巴瘤及白血病的IND申请,并于2018年1月获得受理。基于此,药明巨诺也成为在国内首家拿下CD19 CAR-T临床批件的药企。随后,NMPA于2020年6月受理瑞基奥仑赛用于弥漫性大B细胞淋巴瘤(DLBCL)三线疗法的新药上市申请,并于2020年9月纳入优先审评。
此次瑞基奥仑赛在国内获批则是根据药明巨诺在2020年美国血液学会(ASH)年会公布的相关数据,其中,58例可评估有效性的复发或难治性(r/r)大B细胞淋巴瘤患者中经瑞基奥仑赛治疗后,3个月的客观缓解率(ORR)为58.6%;客观缓解率(BOR)为75.9%,完全缓解率(CR)为51.7%;中位随访时间为8.9个月,中位总生存期(OS)尚未达到,6个月的OS率为90.8%;6个月缓解持续时间(DOR)为60%;6个月的无进展生存率(PFS)为54.2%。安全性方面,瑞基奥仑赛相关不良事件可控,未发生 CRS 或 NT 相关性死亡,3/4 级 CRS 或 NT 发生率低,约为6%。
此外,面对国内市场,药明巨诺已抢先一步向NMPA递交瑞基奥仑赛用于复发或难治性滤泡淋巴瘤的上市申请,并被纳入突破性疗法品种,而复星凯特的阿基仑赛用于该适应症的开发还处于临床早期阶段。
2、瑞基奥仑赛其他在研适应症
研究表明,CD19属于近年来免疫疗法的重要靶点,主要在B细胞淋巴瘤和白血病的肿瘤细胞中表达,而在造血干细胞和非造血细胞中不表达。
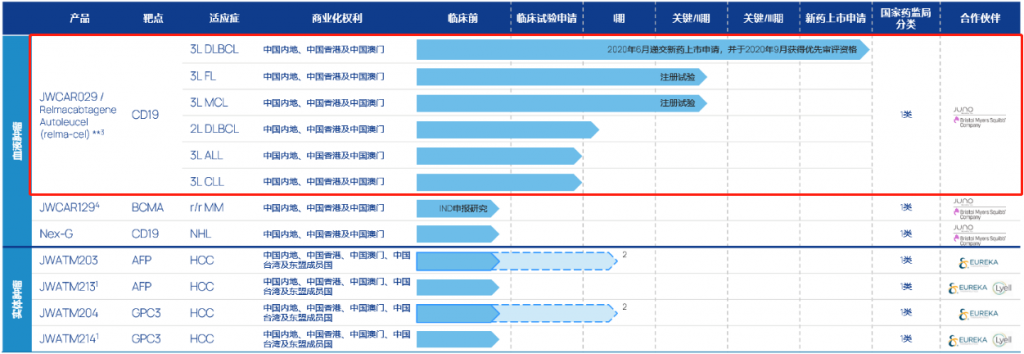
瑞基奥仑赛作为靶向CD19的CAR-T细胞疗法,已在国内拿下弥漫性大B细胞淋巴瘤(DLBCL)三线疗法的首个适应症,且用于滤泡性淋巴瘤(FL)、套细胞淋巴瘤(MCL)的新适应症已经入关键的临床阶段,NMPA也已授予瑞基奥仑赛治疗滤泡性淋巴瘤的突破性疗法认定。而有关慢性淋巴细胞白血病(CLL)、二线大B细胞淋巴瘤(2L LBCL)及急性淋巴细胞白血病(ALL)新适应症的开发也处于临床早期阶段。
据弗若斯特沙利文的统计,非霍奇金淋巴瘤(NHL)约占所有淋巴瘤80%~90%,而2019年中国的NHL患病人数达到48.55万,并将以4.7%的年复合增长率增长至2024年的61.09万。其中,弥漫大B细胞淋巴瘤(DLBCL)是中国最常见的NHL亚型,占比约41%,而FL、MCL和CLL亚型分别为 6.1%、3.4%和4.6%。而瑞基奥仑赛可开发用于DLBCL、FL、MCL、ALL及CLL适应症,有望成为NHL的主要治疗药物。
除了CD19,药明巨诺的产品管线中还包含BCMA、AFP、GPC3等热门靶点,涉及血液恶性肿瘤,及难度更大的实体瘤领域。
其中,BCMA是一种在包括多发性骨髓瘤等在内的众多血液恶性肿瘤中高度表达的蛋白质,而WCAR129是以BCMA为靶点的自体CAR-T产品,拟开发用于多发性骨髓瘤(MM),WCAR129与其他以BCMA为靶点的CAR-T疗法相比,在接受过多达十次前线治疗仍无法控制疾病的复发或难治性多发性骨髓瘤患者中,已展现出高缓解率及可控的毒副作用。
JWATM203及JWATM204是以优瑞科的ARTEMIS平台为基础进行开发,以开发潜在疗效及安全性更佳、肿瘤浸润性更强的T细胞疗法。且药明巨诺也已通过与 Lyell Immunopharma(Lyell)订立合作协议,计划将Lyell的技术与ARTEMIS平台相结合,为肝细胞癌(HCC)治疗开发新一代自体细胞疗法。
小结:
截止目前,全球已有多款CAR-T细胞疗法获批上市,且诺华Kymriah、吉利德的Yescarta、BMS的Breyanzi、复兴凯特的阿基仑赛及药明巨诺的瑞基奥仑赛均为可用于B细胞淋巴瘤的CD19 CAR-T细胞疗法,不过从临床数据来看,瑞基奥仑赛已显示出类似的初步缓解率,并在接受既往重度治疗且风险较高的r/r LBCL患者中具有高于其他几款CAR-T产品的安全性。
众所周知,药品的安全性可直接导致其销量,譬如Kymriah、Yescarta,从销售数据来看,Kymriah每年披露的销售额均低于Yescarta,而这主要与Kymriah具有较大的副作用有关。其中,Yescarta细胞因子释放综合征(CRS)的发生率为13%,而Kymriah为23%。
然而即便拥有更高的安全性,瑞基奥仑赛作为一种细胞疗法,仍绕不开治疗费用高昂的现实问题,因此,价格无疑成为细胞疗法持续产业化的一大痛点。
且药明巨诺联合创始人兼首席执行官李怡平曾提到:“降低成本是CAR-T疗法可持续发展的重要因素之一,未来随着生产水平提升,我们肯定可以提供更适合的治疗价格,进一步扩大CAR-T疗法的价值。但短期内,生产成本依旧难以降低,不过企业将在商业化过程中努力争取商业保险以及与医保达成合作,尽可能帮助更多患者从该疗法获益。”
值得一提的是,随着阿基仑赛及瑞基奥仑赛成功上市,将进一步促进国内CAR-T疗法的发展。 据了解,平安健康已将CAR-T治疗添加至基础药品清单上,进商保无疑将进一步推动CAR-T在国内的发展。期待CAR-T在国内早日惠及更多患者。


文章评论(0)