三迭纪T20获美国FDA IND批准 全球小分子药物销售冠军有望迎来迭代产品
近日,南京三迭纪医药科技有限公司(简称“三迭纪”,英文名Triastek)宣布,该公司自主研发的3D打印药物产品T20已获得美国FDA的临床试验批准(IND)。这是三迭纪在FDA获批的第二个IND,也是全球第三款进入注册申报阶段的3D打印药物产品。
三迭纪的T20在美国FDA的注册申报路径是505(b)(2),原研产品从2018年起连续四年为全球小分子药物销售冠军。原研产品为速释片,需要一天服用两次,临床疗效包括降低非瓣膜病性房颤患者的卒中和全身性栓塞风险、预防和治疗深静脉血栓(DVT)和肺栓塞(PE)等。美国临床关键意见领袖表示:如果将一天两次服用的药物改为一天一次,可以减轻房颤患者用药负担,提高预防DVT和PE患者的依从性,降低血栓发生风险,从而为患者提供更好的临床用药选择。
公开信息显示,原研公司尝试过多种技术手段来开发一天一次的制剂产品,其专利公布了与速释制剂相比,同样剂量一天一次调释制剂的相对生物利用度只有50~70%,达峰后浓度快速下降。其主要原因在于,一天一次日剂量下此药物的溶解度很低,并且随着肠道转运至远端小肠和升结肠后,药物的渗透性也大幅降低,难以被有效吸收。此药物的低溶解度和体内低渗透性对开发一天一次的产品,带来了很大的技术挑战。
三迭纪创新的数字化制剂开发方法和独有的程序化释药技术,给只需服用一天一次的T20产品的开发提供了技术解决方案,以期达到传统制剂技术难以实现的药物代谢动力学曲线。三迭纪开发了3D打印剂型源于设计(3D Printing Formulation by Design, 3DFbD®)的数字化制剂开发方法,首先根据优化的目标药代动力学曲线,应用基于生理学的生物药剂学模型,根据文献人体参数,计算出体内不同时间和空间的目标释放曲线;然后根据该目标释放曲线,使用热熔挤出沉积(Melt Extrusion Deposition, MED®)3D打印技术,设计并制备含有多腔室的药物结构制剂,实现释药的“3R”精准控制,即药物在正确的时间(Right time),以正确的剂量(Right amount),递送到人体正确的胃肠道部位(Right location),使得药物被有效吸收。三迭纪研发的T20产品原型,已经在比格犬体内得到了验证,下阶段将推进小规模临床药代动力学研究。
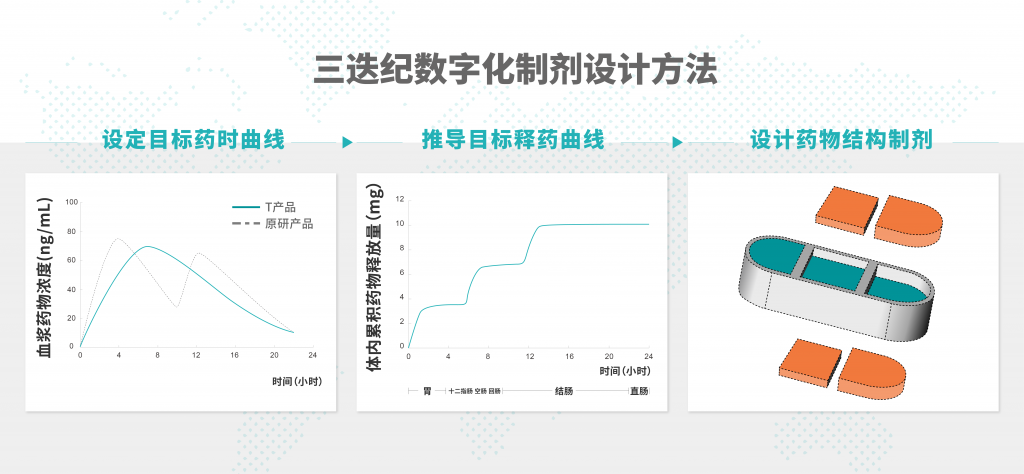
2021年在完成前期可行性研究后,三迭纪向美国FDA递交了T20的PIND会议申请,得到了FDA有关产品开发计划的积极正面的回复。FDA同意,通过临床药代动力学研究与原研建立桥接关系,T20即可申报上市,因此产品开发的时间和成本显著减少。
三迭纪定位为3D打印制剂技术平台型公司,覆盖产品设计、开发和生产全链条,具有自主研发产品和合作开发产品并行的商业模式。其自主开发的全球T系列产品为505(b)(2)药物,原研均为该疾病领域在售重磅小分子药物,三迭纪运用独特的程序化释药技术对其进行产品改良,并对外许可其全球商业权力。作为拥有原创技术的新兴制药科技公司,三迭纪的全球T系列产品肩负着将MED 3D打印技术用于药物产品开发、国际申报注册、GMP生产、商业化,以及实现公司全球化的使命。此外,三迭纪基于专有的3D打印制剂技术平台,已经和多家跨国药企及国内药企合作,共同开发具有高难度制剂技术的505(b)(1)产品,以及具有高度差异化的505(b)(2)产品。
T20是三迭纪自主研发的全球T系列产品中的第二款,原研为全球最畅销的抗凝血药物,化合物在美国、欧洲、日本等主要市场国家和地区仍在专利保护期,全球市场销售预期将持续攀升,年销售峰值预估高达220亿美元。作为原研生命周期管理的新一代改良型产品,T20将积极探索产品商业许可的机会,并将根据商业合作推进国际注册申报和临床研究进程。
三迭纪创始人、CEO成森平博士说:“新兴制药技术从开发到应用,通常需要30年,3D打印制药已经走过26年。目前,全球共有四款注册申报的3D打印药物产品,三迭纪有幸贡献了其中三款。T20获得FDA的IND,既是三迭纪的里程碑,也是3D打印制药领域的重要进展。”




文章评论(0)